Telah kita pelajari tentang pengertan termokimia pada postingan sebelumnya. Bahwa Termokimia adalah cabang ilmu kimia yang mempelajari tentang perubahan kalor atau energi yang menyertai suatu reaksi kimia, baik yang diserap maupun yang dilepaskan. Untuk lebih lengkap nya.

Dibawah ini admin sajikan beberapa contoh soal dan pembahasannya tentang materi termokimia.
Soal No.1
Diketahui 1 mol NO terurai menjadi unsur-unsur pembentuknya dengan melepaskan kalor sebesar 90,4 kJ.
a. Tuliskan persamaan termokimia dari reaksi tersebut!
b. Gambarkan diagram tingkat energinya!
c. Tentukan perubahan entalpi untuk reaksi pembentukan 1,5 mol zat tersebut dan persamaan termokimianya!
Pembahasan:
a. Reaksi penguraian NO melepaskan kalor. Dengan demikian, perubahan entalpinya berharga negatif. Persamaan termokimia untuk 1 mol NO sebagai berikut.
NO(g) → ⅟2 N2(g) + ⅟2 O2(g) ∆H = -90,4 kJ/mol
b. Diagram tingkat energinya:
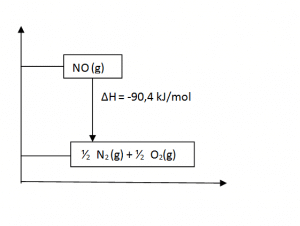
c. Perubahan entalpi pembentukan untuk 1,5 mol NO sebagai berikut.
Reaksi pengurai:
NO(g) → ⅟2 N2(g) + ⅟2 O2(g) ∆H = -90,4 kJ/mol
Reaksi pembentukan:
NO(g) → ⅟2 N2(g) + ⅟2 O2(g) ∆H = -90,4 kJ/mol
untuk 1,5 mol NO perubahan entalpinya sebesar 1,5 x 90,4 kJ = 135,6 kJ.
Jadi, persamaan termokimia untuk pem-bentukan 1,5 mol NO sebagai berikut.
N2(g) + O2(g) → 2NO(g) ∆H = + 135,6 kJ
Soal No.2
Kelompokkan reaksi-reaksi di bawah ini ke dalam reaksi endoterm atau reaksi eksoterm!
a. N204 (g) → 2N02(g) ∆H = +58 kJ
b. N2(g) + 3H2(g) → 2NH3(g) ∆H = -92 kJ
c. HCI(aq) + NaOH(aq) → NaCI(aq) + H20(ℓ) ∆H = -56 kJ
d. 2C(s) + H2(g) → C2H2(g) ∆H = +225 kJ
Pembahasan:
Reaksi:
- 2C(s) + H2(g) → C2H2(g) ∆H = +225kJ
- N204(g) → 2NO2(g) ∆H = +58 kJ
Termasuk reaksi endoterm karena memiliki ∆H positif. Sementara itu, reaksi:
- HCI(aq) + NaOH(aq) → NaCI(aq) + H20(ℓ) ∆H = -56 kJ
- N2(g) + 3H2(g) → 2NH3(g) ∆H = -92kJ
Termasuk reaksi eksoterm karena memiliki AH negatif.
Soal No.3
Diketahui entalpi pembentukan 14 g gas etilena (C2H4) adalah +26,15kJ.
a. Berapakah besarnya kalor yang dilepaskan untuk menguraikan 84 g gas etilena menjadi unsur-unsurnya?
b. Tuliskan persamaan termokimianya!
Pembahasan:
Perbandingan koefisien = perbandingan mol

Soal No.4
Diketahui persamaan termokimia reaksi pembakar- an gas asetilen (C2H2) sebagai berikut.
2C2H2(g) + 502(g) → 4C02(g) + 2H20(ℓ)
∆H = -2.599,1 kJ.
a. Tentukan entalpi pembakaran standar gas asetilen!
b. Hitung kalor yang dihasilkan pada pembakaran 10 L gas asetilen!
Pembahasan:
a. Entalpi pembakaran standar gas asetilen sebagai berikut.
Reaksi pembakaran pada persamaan reaksi 2C2H2 + 5O2 -+ 4CO2+ 2H2O menunjukkan bahwa pembakaran tersebut dilakukan untuk 2 mol gas C2H2, dengan membebaskan kalor sebesar 2.599,1 kJ. Oleh karena itu, entalpi pembakaran standar gas asetilen harus ditentukan untuk 1 mol gas asetilen. Dengan demikian, besarnya entalpi pembakaran standar gas asetilen adalah 2.599,1 kJ : 2 = 1.299,6 kJ.
b.Besarnya kalor yang dihasilkan pada pem-bakaran 10 L gas asetilen sebagai berikut. mol gas asetilen pada kondisi standar:

Soal No.5
Diketahui entalpi pembentukan standar (∆H°f) H20(ℓ) = -285,85 kJ/mol. Berapakah kalor yang diperlukan untuk menguraikan 13 gram air menjadi hidrogen dan oksigen pada keadaan standar? (Ar H = 1, Ar O = 16)
Pembahasan:
AH°f H20(ℓ) = -285,85 kJ/mol
Persamaan termokimia reaksi pembentukan H20:
H2(g) + ⅟2 O2(g) →H20(ℓ) ∆H = -285,85 kJ/mol.
Persamaan termokimia reaksi penguraian H20(ℓ)
H20(ℓ) →H2(g) + ⅟2 O2(g) ∆H =+285,85 kJ/mol.
Jumlah mol air dalam 10 gram air = 13 g /18g/mol – 0,72 mol.
Kalor yang diperlukan untuk menguraikan 13 g air = 0,72 mol/ 1 mol x 285,85 kJ/mol = 205,812 kJ/mol
Jadi, kalor yang diperlukan untuk menguraikan 13 gram air menjadi hidrogen dan oksigen sebesar 205,812 kJ.
Artikel Paling Populer :
- Menyelesaikan Masalah Dengan Menggunakan Konsep Himpunan Jika Anda amati masalah dalam kehidupan sehari-hari maka banyak di antaranya dapat diselesaikan dengan konsep himpunan. Agar dapat menyelesaikannya, Anda harus memahami kembali mengenai konsep diagram Venn dan Anda harus dapat menyatakan permasalahan…
- Rumus Barisan Dan Deret Aritmatika Beserta Contoh… Rumus Barisan Dan Deret Aritmatika Beserta Contoh Soal Dan Penyelesaian Lengkap – Aritmatika atau Aritmetika berasal dari bahasa yunani αριθμός yang berarti angka yang dulu biasa disebut dengan Ilmu Hitung yaitu cabang tertua atau pendahulu…
- Materi Kalor Ada yang sudah mengenal atau pernah mendengar mengenai istilah Kalor? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Kalor Kalor merupakan salah satu bentuk energi yang dapat berpindah dari satu benda…
- Pengertian dan Contoh Perubahan kimia Perubahan pada zat dibedakan menjadi dua yaitu perubahan fisika dan perubahan kimia. Untuk perubahan secara fisika sudah dibahas pada postingan sebelumnya yang berjudul "perubahan fisika". Pada postingan ini hanya dibahas mengenai perubahan…
- Rumus Dan Pembahasan Contoh Soal Persamaan Lingkaran… Rumus Dan Pembahasan Contoh Soal Persamaan Lingkaran Matematika Lingkaran adalah tempat kedudukan atau himpunan titik titik yang berjarak sama terhadap suatu titik tertentu. Titik tertentu tersebut dinamakan pusat lingkaran dan…
- Jenis Jenis Hubungan Kuantitatif Antara Pereaksi dan… Guldberg dan Waage mengemukakan hukum kesetimbangan dalam reaksi kesetimbangan kimia sebagai berikut. ”Dalam keadaan setimbang pada suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi hasil kali konsentrasi pereaksi yang ada dalam sistem kesetimbangan…
- Pengertian Teori Tumbukan dan Faktor-Faktor yang… Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna.…
- Perubahan Kimia Perubahan kimia yang berhubungan dengan mudah sukarnya benda bereaksi kimia. Dalam kehidupan sehari-hari misalnya nasi yang menjadi basi karena terjadi adanya perubahan kimia. Untuk lebih jelas lagi mari simak ulasan…
- SEL ELEKTROKIMIA SEL VOLTA (GALVANI) ELEKTROLISIS Energi kimia menjadi energi listrik Energi listrik diubah menjadi energi kimia Reaksi redoks spontan Reaksi redoks tidak spontan Katoda (+) dan anoda (-) Katoda (-) dan…
- Unsur Oksigen Hai sobat hitung, bagaimana kabarnya? Semoga tetap sehat dan semangat ya… Nah, kali ini kami akan menjelaskan sedikit tentang materi kimia, yaitu mengenai unsur oksigen dan nitrogen. Harus kalian ketahui…
- 5 Contoh Soal Kimia Dan Pembahasan Terlengkap… Telah kita pelajari tentang pengertan termokimia pada postingan sebelumnya. Bahwa Termokimia adalah cabang ilmu kimia yang mempelajari tentang perubahan kalor atau energi yang menyertai suatu reaksi kimia, baik yang diserap…
- Termokimia Jadi termokimia apa sih? kita bakal ngebahas tentang sistem dan lingkungan, yuk langsung saja! Perubahan Entalpi Entalpi sendiri itu delta H, jadi perubahan energi pada suatu zat Ada dua jenis:…
- Mempelajari Sistem Persamaan Linier Dan Metode… Sistem persamaan linier sebenarnya hampir sama dengan persamaan aljabar, yakni sebuah sistem penghitungan yang menggunakan metode matematika dan juga dapat di gambarkan dengan menggunakan bentuk garis lurus dalam sebuah grafik.…
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi… Setiap reaksi yang berlangsung selalu melibatkan komponen-komponen berupa pereaksi, hasil reaksi, dan laju reaksi. Rada saat reaksi berlangsung, konsentrasi zat pereaksi dan zat hasil reaksi akan mengalami perubahan. Reaksi ada…
- Pengertian Persamaan Linear Satu Variabel Masih ingatkah Anda dengan kalimat terbuka dan himpunan menyelesaikan kalimat terbuka? Kalimat terbuka adalah kalimat yang memuat variabel dan belum diketahui nilai kebenarannya, sedangkan himpunan penyelesaian dari kalimat terbuka adalah…
- Unsur Nitrogen Definisi Nitrogen Nitrogen merupakan unsur kimia dalam tabel periodik yang mempunyai lambang N dan nomor atom 7. Unsur ini biasanya ditemukan dalam bentuk gas tanpa warna dan bau. Merupakan gas…
- Pengertian , Struktur, Sistem Kerja dan Faktor yang… Pengertian , Struktur, Sistem Kerja dan Faktor yang Memengaruhi Kerja Enzim Pada Sistem Metabolisme Metabolisme adalah semua reaksi kimia yang terjadi pada sel hidup, Metabolisme meliputi Katabolisme dan Anabolisme. Katabolisme adalah…
- Hidrolisis Garam : Pengertian, Macam, Dan Rumus,… Karena pada kesempatan kali ini disini akan mengulas tentang pengertian Hidrolisis Garam, macam Hidrolisis Garam, dan rumus Hidrolisis Garam beserta contoh soalnya secara lengkap. Oleh karena itu marilah simak ulasan…
- Laju Reaksi Apa Itu Laju Reaksi? Jadi laju reaksi itu adalah ya, laju dari sebuah reaksi. Bagaimana pengurangan suatu konsentrasi pereaksi atau penambahan konsentrasi. Satuannya adalah mol dm-3 atau M s-1 Pengurangan…
- Pengertian Energi, Satuan, Macam Bentuk dan… Pengertian Energi, Satuan, Macam Bentuk dan Pemanfaatan Energi – Energi adalah sebuah kemampuan untuk melakukan sebuah tindakan / pekerjaan (usaha). Kata “Energi” berasal dari bahasa yunani yaitu “ergon” yang berarti kerja.…



