Titrasi asam-basa merupakan suatu cara yang cukup teliti untuk menentukan konsentrasi suatu asam atau basa. Konsentrasi suatu asam ditentukan dengan cara menitrasi asam dengan basa yang telah diketahui kadarnya, begitu puia sebaliknya. Titrasi asam kuat basa kuat dinamakan pula reaksi netralisasi atau penetralan karena pada reaksi menghasilkan garam dan air. Dalam titrasi asam-basa, zat penitrasi disebut sebagai titran atau titer, sedangkan zat yang dititrasi disebut titrat. Titran merupakan larutan baku yang telah diketahui konsentrasinya dan ditempatkan di dalam buret. Titrat merupakan zat yang dianalisis dan belum diketahui konsentrasinya, ditempatkan dalam erlenmeyer yang berada tepat di bawah buret berisi titran.
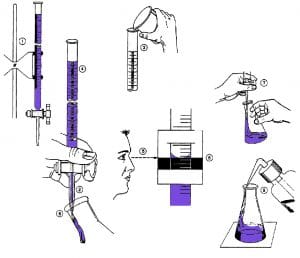
Sebelum proses titrasi berlangsung, ke dalam titrat ditambahkan indikator asam-basa untuk mengetahui titik akhir titrasi. Indikator asam-basa akan menunjukkan perubahan warna apabiia titik ekuivalen telah tercapai. Titik ekuivalen adalah keadaan yang secara stoikiometri titran dan titrat tepat habis bereaksi. Saat titik ekuivalen tercapai, konsentrasi asam sama dengan konsentrasi basa atau jumlah mol ekuivalen basa yang ditambahkan sama dengan jumlah mol ekuivalen asam yang dinetralkan.
Stoikiometri Larutan Asam-Basa
Indikator asam-basa biasanya bersifat asam lemah. Indikator asam-basa akan memberikan warna yang berbeda dalam asam maupun dalam basa.Ketika titrasi mencapai titik ekuivalen, mol ekuivalen asam sama dengan mol ekuivalen basa. Mol ekuivalen diperoleh dari hasil perkalian antara normalitas (N) dengan volume (V). Rumus ini ditulis sebagai berikut.
Vasam x Nasam = Vbasa x Nbasa
Normalitas (N) diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah mol ion H+ dari asam atau jumlah mol ion OH- dari basa.
Vasam x M x n = Vbasa x M x n
Keterangan:
V = volume
N = normalitas
M = Molaritas
n = jumlah ion H+ (pada asam) atau ion OH (pada basa)
Grafik Titrasi Asam-Basa
Titrasi asam-basa dibedakan menjadi tiga jenis, yaitu titrasi asam kuat-basa kuat, titrasi asam lemah-basa kuat, dan titrasi basa lemah-asam kuat. Titrasi asam-basa dapat digambarkan dengan sebuah grafik titrasi. Grafik titrasi menyatakan perubahan pH pada proses titrasi.
Titrasi Asam Kuat-Basa Kuat
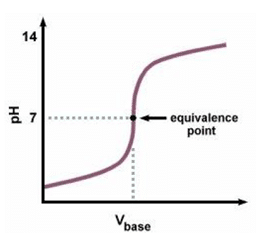
Contoh titrasi asam kuat-basa kuat terjadi pada larutan HN03 0,1 M dengan larutan NaOH 0,1 M. Titrasi antara larutan HN03 0,1 M sebanyak 25 ml dengan larutan NaOH 0,1 M dapat digambarkan
Titik ekuivalen terjadi pada pH 7 saat volume NaOH 25 ml. Pada saat titrasi berlangsung daerah sekitar titik ekuivalen terjadi perubahan pH yang cukup drastis. Titik ekuivalen pada titrasi asam kuat dengan basa kuat dapat ditunjukkan dengan indikator metil merah, bromtimol biru, dan fenolftalein.
Titrasi asam lemah-basa kuat
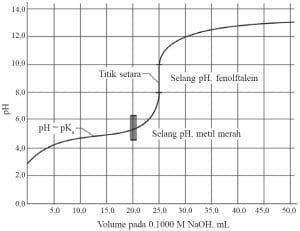
Contoh titrasi asam lemah-basa kuat terjadi pada larutan HCOOH 0,1 M dengan larutan NaOH 0,1 M. Titrasi antara larutan HCOOH 0,1 M sebanyak 25 ml dengan larutan NaOH 0,1 M dapat digambarkan dengan Grafik di samping.
Pada titrasi asam lemah-basa kuat, perubahan pH di sekitar titik ekuivalen terjadi pada pH di atas 7 hingga pH 10. Titik akhir titrasi diharapkan sedekat mungkin dengan titik ekuivalen. Indikator metil merah akan menunjukkan perubahan warna jauh sebelum titik ekuivalen tercapai. Oleh karena itu, indikator yang tepat untuk menunjukkan titik ekuivalen ini adalah fenolftalein.
Titrasi Basa Lemah-Asam Kuat
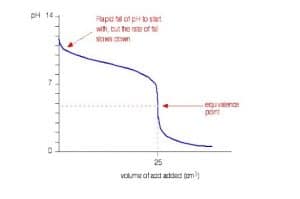
Contoh titrasi basa lemah-asam kuatterjadi pada larutan NH4OH 0,1 M dengan larutan HCI 0,1 M. Titrasi antara larutan NH4OH 0,1 M sebanyak 25 ml dengan larutan HCI 0,1 M dapat digambarkan dengan Grafik berikut.
Pada titrasi ini, perubahan pH di sekitar titik ekuivalen berkisar antara ±7 – ±4. Titik ekuivalen terjadi pada pH di bawah 7 sehingga indikator yang sesuai digunakan adalah metil merah. Indikator fenolftalein tidak digunakan dalam titrasi basa lemah dengan asam kuat karena indikator fenolftalein akan menunjukkan perubahan warna jauh sebelum titik ekuivalen tercapai.
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian Tritrasi,Stoikiometri Larutan Dan Grafik Titrasi Asam-Basa. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Pengertian, Rumus dan Contoh Soal Molaritas,… Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap – Kali ini kita aka membahas tentang pengertian dan rumus molaritas, pembuatan larutan dan pengenceran beserta dengan contoh soal dan…
- Materi Benzena Ada yang sudah mengenal atau pernah mendengar mengenai Benzena? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Benzena Bеnzеnа merupakan ѕuаtu рrоduk mіnуаk bumi yang аwаlnуа tеrbuаt dаrі bаtubаrа уаng dіраkаі…
- Apa Pengertian Senyawa Mungkin kalian bingung dengan pengertian dari senyawa dan molekul. Apakah senyawa dan molekul memiliki definisi yang berbeda atau sama? Baiklah kita sekarang akan bahas terlebih dahulu tentang senyawa. Senyawa adalah zat yang…
- Definisi dan Contoh Senyawa Terner Pada postingan kali ini akan membahas mengenai senyawa terner. Setelah artikel kami cari di mesin pencarian google tentang senyawa terner, malah kami kebingungan. Ada beberapa blog atau website yang menjelaskan bahwa “senyawa…
- Teori – Teori dan Konsep Asma Basa Menurut Para Ahli… Pernahkah Anda melihat pohon asam jawa? Buah asam jawa tumbuh bergelantung dengan beberapa biji dalam setiap buahnya. Beberapa kandunga asam jawa berupa senyawa asam seperti asam sitrat, asam tartart, asam…
- Pengertian, Rumus dan Contoh Soal Molalitas dan… Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam…
- Perubahan Kimia Perubahan kimia yang berhubungan dengan mudah sukarnya benda bereaksi kimia. Dalam kehidupan sehari-hari misalnya nasi yang menjadi basi karena terjadi adanya perubahan kimia. Untuk lebih jelas lagi mari simak ulasan…
- Ini 3 Cara Mengatasi Anosmia Menurut Saran Dokter Seperti yang diketahui, anosmia merupakan ketidakmampuan atau terjadi penurunan kemampuan untuk mencium. Hal ini bisa saja terjadi secara permanen maupun sementara. Sebab, faktanya ada beberapa orang yang memang memiliki anosmia…
- Faktor Faktor yang Mempengaruhi Pergeseran… Henry Louis Le Chatelier (1850-1936), ilmuwan kimia dari Prancis, pada tahun 1884 menyatakan bahwa ’’apabila dalam suatu kesetimbangan dilakukan tindakan (aksi) maka sistem kesetimbangan tersebut akan mengadakan reaksi sehingga pengaruh…
- Pengertian, Rumus dan Contoh Soal Molalitas dan… Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam…
- Pengertian Reaksi Kimia, Kesetimbangan Kimia, dan… Pernahkah Anda mengamati keadaan gua? Pada umumnya, keadaan di dalam gua adalah lembap, banyak tetesan air, stalaktit, dan stalakmit. Stalaktit dan stalakmit terbentuk dari endapan mineral kalsium karbonat (CaCO3). Endapan…
- Pengertian Batuan Beku, Proses Pembentukan, Jenis,… Pengertian, Proses Pembentukan, Jenis, Contoh dan Ciri-Ciri Batuan Beku Lengkap – Batuan beku atau batuan igneus merupakan jenis batuan yang terbentuk dari magma yang mendingin dan mengeras dengan atau tanpa…
- Faktor-Faktor yang Mempengaruhi Kelarutan Dan… Dalam kehidupan sehari-hari kita sering mendengar ungkapan mudah larut dan sukar larut. Suatu senyawa elektrolit akan mudah larut jika berada dalam larutan kurang jenuh. Sebaliknya, suatu senyawa elektrolit akan sukar…
- Penjelasan Lengkap tentang Katabolisme, Pengertian… Penjelasan Lengkap tentang Katabolisme, Pengertian dan Jenis Katabolisme Melanjutkan postingan sebelumnya seputar anabolisme dan enzim. Kali ini kita akan bahas tuntas mengenai katabolisme. Simak uraian berikut ini. Sebelum diserap oleh…
- Hidrolisis Garam : Pengertian, Macam, Dan Rumus,… Karena pada kesempatan kali ini disini akan mengulas tentang pengertian Hidrolisis Garam, macam Hidrolisis Garam, dan rumus Hidrolisis Garam beserta contoh soalnya secara lengkap. Oleh karena itu marilah simak ulasan…
- Pengertian Kelarutan (k) Dan Hasil Kali Kelarutan (Ksp) Kemampuan garam larut dalam air berbeda-beda. Natrium klorida (NaCI) termasuk salah satu contoh garam yang mudah larut dalam air. Apabila NaCI dilarutkan dalam air, mula-mula akan larut. Namun, jika semakin…
- Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi… Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi Asam Basa Terlengkap – Tentu saja kita sering mendengar istilah asam basa dalam kimia. Kata asam berasal dari bahasa Latin acidu” yang berarti…
- Cara Pembuatan Koloid – Cara Kondensasi Dan Cara… Sistem koloid berada di antara larutan sejati dan suspensi. Jadi, susu merupakan koloid yang berada di antara larutan gula (larutan sejati) dan campuran air dengan pasir (suspensi). Oleh karena itu,…
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi… Setiap reaksi yang berlangsung selalu melibatkan komponen-komponen berupa pereaksi, hasil reaksi, dan laju reaksi. Rada saat reaksi berlangsung, konsentrasi zat pereaksi dan zat hasil reaksi akan mengalami perubahan. Reaksi ada…
- Asam Basa – Penentuan pH Asam Kuat Dan Basa Kuat… Setelah kita mempelajari tentang pH, pOH, dan pKw, dikatakan bahwa Istilah pH digunakan untuk menyatakan keasaman atau kebasaan suatu larutan. Istilah pH berasal dari potential of hydrogen yang dikemukakan oleh…



