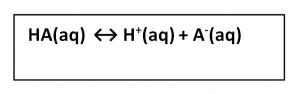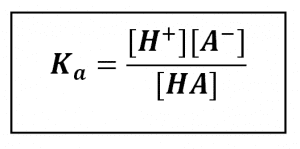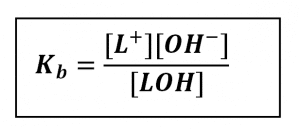Asam lemah banyak terdapat dalam buah-buahan seperti mangga, apel, dan jeruk. Asam lemah tidak berbahaya dan boleh dimakan. Basa lemah, seperti aluminium hidroksida (AI(OH)3) dapat ditemukan dalam obat mag. pH larutan asam lemah dan basa lemah dapat ditentukan jika diketahui tetapan kesetimbangannya. Beberapa hal yang berhubungan dengan asam lemah dan basa lemah sebagai berikut.

Derajat Ionisasi
Larutan dikelompokkan menjadi asamtcuat, asam lemah, basa kuat, dan basa lemah. Asam kuat mengalami ionisasi sempurna (α = 1) dan nilai pH rendah (konsentrasi molar ion H+ tinggi). Sementara itu, asam lemah terionisasi sebagian (0 < α < 1). Banyaknya zat yang mengalami ionisasi dinyatakan dengan derajat ionisasi. Derajat ionisasi (α) merupakan perbandingan antarajumlah zat yang terionisasi dengan jumlah zat yang dilarutkan.

Tetapan Kesetimbangan
Asam lemah mengalami ionisasi sebagian (a < 1) dan nilai pH sedang. Larutan asam lemah mengandung molekul-molekul asam, ion-ion H+, dan ion-ion sisa asam yang berada dalam kesetimbangan. Secara umum, ionisasi asam lemah valensi satu dirumuskan sebagai berikut.
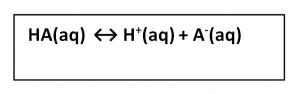
Tetapan kesetimbangan ionisasi asam lemah disebut tetapan ionisasi asam, dilambangkan dengan Ka. Ungkapan tetapan ionisasi untukasam lemah pada persamaan di atas sebagai berikut.
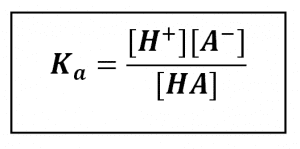
Harga Ka untuk asam lemah kecil. Semakin kecil harga a asam lemah, semakin kecil pula harga Ka- nya. Hubungan antara derajat ionisasi dengan tetapan kesetimbangan ionisasi asam lemah sebagai berikut.
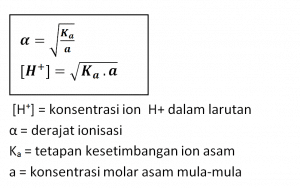
Basa lemah mengalami ionisasi sebagian (α < 1). Larutan basa lemah mengandung molekul-molekul basa, ion-ion OH–, dan ion-ion logam yang berada dalam kesetimbangan. Reaksi ionisasi basa lemah, secara umum dirumuskan sebagai berikut.
LOH (aq)↔ L+(aq) + OH– (aq)
Tetapan kesetimbangan ionisasi basa lemah disebut tetapan ionisasi basa, dilambangkan dengan Kb. Ungkapan tetapan ionisasi untuk basa lemah pada persamaan di atas sebagai berikut.
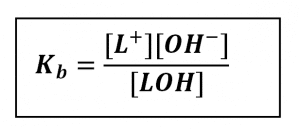
Harga Kb basa lemah kecil. Semakin kecil harga a basa lemah, semakin kecil harga Kb. Hubungan antara derajat ionisasi dengan tetapan kesetimbangan ionisasi basa lemah sebagai berikut.
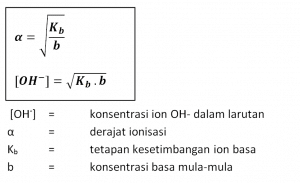
Harga pH larutan asam lemah atau basa lemah dapat dihitung jika derajat ionisasi atau Ka/Kb-nya diketahui.
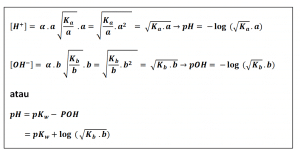
Asam lemah polivalen memiliki atom H lebih dari satu dalam molekulnya. Ionisasi asam lemah polivalen berlangsung bertingkat-tingkat. Tiap tingkatan ionisasi memiliki harga Ka yang berbeda-beda. Ionisasi tingkat pertama lebih mudah dari ionisasi tingkat kedua, dan seterusnya. Oleh sebab itu, harga Ka tingkat pertama lebih besar dari tingkat kedua, dan seterusnya. Harga pH asam lemah polivalen dihitung dengan menggunakan harga Ka yang paling besar.
Demikian penjelasan yang bisa kami sampaikan tentang Menghitung pH Larutan Asam Lemah dan Basa Lemah. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Penjelasan Lengkap tentang Katabolisme, Pengertian… Penjelasan Lengkap tentang Katabolisme, Pengertian dan Jenis Katabolisme Melanjutkan postingan sebelumnya seputar anabolisme dan enzim. Kali ini kita akan bahas tuntas mengenai katabolisme. Simak uraian berikut ini. Sebelum diserap oleh…
- Pengertian Senyawa Kimia, Ciri, Sifat, Jenis dan… Pengertian Senyawa Kimia, Ciri, Sifat, Jenis dan Tata Nama Senyawa Kimia Beserta Contohnya Lengkap – Senyawa kimia adalah zat kimia murni yang terdiri dari dua atau beberapa unsur yang bisa…
- Ini 3 Cara Mengatasi Anosmia Menurut Saran Dokter Seperti yang diketahui, anosmia merupakan ketidakmampuan atau terjadi penurunan kemampuan untuk mencium. Hal ini bisa saja terjadi secara permanen maupun sementara. Sebab, faktanya ada beberapa orang yang memang memiliki anosmia…
- Pengertian, Rumus dan Contoh Soal Mol, Molalitas,… Pengertian, Rumus dan Contoh Soal Menghitung Mol, Molalitas, Molaritas, Normalitas, Part Per Million (ppm), Persen Massa dan Persen Volume Larutan Lengkap – Dalam kimia, ada beberapa satuan yang sering digunakan untuk…
- Hujan Asam: Penyebab, Proses Terjadi, serta Dampaknya Hujan Asam adalah presipitasi dengan kadar keasaman yang tinggi. Keasaman yang tinggi ini dapat dilihat dari keberadaan ion hydrogen yang banyak atau nilai pH yang rendah. Karena sifat asamnya, hujan asam memiliki dampak…
- Yang dimaksud dengan ultranasionalisme adalah Yang dimaksud dengan ultranasionalisme adalah... A. Paham nasionalisme yang angkuh dan ekstrim B. Paham nasionalisme yang liberalis C. Paham nasionalisme yang lemah D. Paham nasionalisme yang menjunjung tinggi demokrasi E.…
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap Postingan sebelumnya admin telah membahas tuntas tentang Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi. Kali ini akan membahas macam-macam perubahan entalpi secara lengkap dengan penjelasannya. Perubahan entalpi yang menyertai suatu reaksi…
- Pengertian Tritrasi,Stoikiometri Larutan Dan Grafik… Titrasi asam-basa merupakan suatu cara yang cukup teliti untuk menentukan konsentrasi suatu asam atau basa. Konsentrasi suatu asam ditentukan dengan cara menitrasi asam dengan basa yang telah diketahui kadarnya, begitu…
- Faktor-Faktor yang Mempengaruhi Kelarutan Dan… Dalam kehidupan sehari-hari kita sering mendengar ungkapan mudah larut dan sukar larut. Suatu senyawa elektrolit akan mudah larut jika berada dalam larutan kurang jenuh. Sebaliknya, suatu senyawa elektrolit akan sukar…
- Pengertian Batuan Beku, Proses Pembentukan, Jenis,… Pengertian, Proses Pembentukan, Jenis, Contoh dan Ciri-Ciri Batuan Beku Lengkap – Batuan beku atau batuan igneus merupakan jenis batuan yang terbentuk dari magma yang mendingin dan mengeras dengan atau tanpa…
- Penjelasan Lengkap Konsep Asam Basa Menurut Para Ahli Penjelasan Lengkap Konsep Asam Basa Menurut Para Ahli | Istilah asam (acid) berasalah dari bahsasa latin acelum yang berarti cuka. Sebaliknya,senyawa yang memiliki sifat sangat berbeda disbanding asam yaitu senyawa alkali…
- Makromolekul : Protein Kali ini kami akan membahas materi kimia tentang asam amino pada makromolekul. Protein Merupakan polimer alam yang tersusun dari asam-asam amino melalui ikatan peptida, sehingga protein juga disebut sebagai polipeptida.…
- Pengertian, Rumus dan Contoh Soal Molalitas dan… Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam…
- Definisi dan Contoh Senyawa Terner Pada postingan kali ini akan membahas mengenai senyawa terner. Setelah artikel kami cari di mesin pencarian google tentang senyawa terner, malah kami kebingungan. Ada beberapa blog atau website yang menjelaskan bahwa “senyawa…
- Bagian terakhir didalam teks negosiasi akan biasanya… Bagian terakhir didalam teks negosiasi akan biasanya berisi tentang basa-basi yang meimiliki arti seperti ucapan terimakasih, termasuk dalam bagian... A. Isi B. Nego C. Penutup D. Penyampaian materi E. Tawar…
- Pengertian DNA dan RNA, Fungsi, Struktur dan… Pengertian DNA dan RNA, Fungsi, Struktur dan Jenisnya Terlengkap – Kali ini kita akan membahas tentang DNA (Deoxyribonucleic acid) dan RNA (Ribonucleic acid), serta fungsi, struktur atau komponen penyusun dan jenisnya lengkap.…
- Atom-atom dibawah ini yang paling lemah menarik… Atom-atom dibawah ini yang paling lemah menarik elektron adalah yang memiliki nomor atom . . . . A. 16 B. 13 C. 9 D. 7 E. 17 Jawaban : D.…
- Satuan Pokok untuk Besaran Kuat Arus Arus listrik adalah banyaknya muatan listrik yang disebabkan dari pergerakan elektron-elektron, mengalir melalui suatu titik dalam sirkuit listrik tiap satuan waktu. Arus listrik dapat diukur dalam satuan Coulomb/detik atau Ampere. Contoh arus listrik dalam…
- Pengertian Batuan Beku : Proses Pembentukan, Jenis,… Pengertian Batuan Beku – Apa yang dimaksud dengan batuan beku? Agar lebih memahaminya, kali ini kita akan membahas tentang pengertian batuan beku, proses pembentukan, jenis, contoh dan ciri-ciri batuan beku secara…
- Makromolekul : Asam Amino Kali ini kami akan membahas materi kimia tentang asam amino pada makromolekul. Asam Amino Asam amino ialah senyawa yang mempunyai gugus asam karbosilat (-COOH) dan gugus amina (-NH2). Rumus umum…