Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam sejumlah massa tertentu dari pelarut. Hal tersebut berbeda dengan definisi molaritas yang berdasarkan pada volume tertentu larutan. Satuan umum molalitas dalam kimia yaitu mol/kg. Suatu larutan dengan konsentrasi 1 mol/kg juga terkadang dinyatakan sebagai 1 molal.
Istilah molalitas ini dibentuk dalam analogi terhadap molaritas yang merupakan konsentrasi molar dari suatu larutan. Molalitas suatu larutan bisa diuji dengan menambahkan beberapa zat pelarut. Lebih sederhananya, Molalitas (m) larutan adalah mol zat terlarut dibagi dengan kilogram pelarut. Kemolalan atau molalitas adalah konsentrasi larutan yang menyatakan jumlah mol (n) zat terlarut dalam 1 kg atau 1000 gram pelarut.
Perbedaan molalitas dan molaritas yaitu jika molalitas adalah kemolalan atau konsentrasi molal (m) menyatakan banyaknya mol zat terlarut dalam 1000 gram pelarut sedangkan molaritas adalah pernyataan jumlah mol zat terlarut dalam setiap satu liter larutan. Molaritas dilambangkan dengan notasi M dan satuannya adalah mol/liter.
Rumus Molalitas
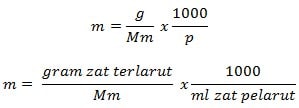
Keterangan
m = molalitas (mol/kg)
g = gram zat terlarut (g)
Mm = massa molar zat (g/mol)
P = massa zat pelarut (g)
Hubungan Molalitas dengan Persen massa
Persen massa adalah satuan konsentrasi yang biasa digunakan dalam larutan kimia. Contohnya larutan yang bisa kita temukan sehari-hari yaitu larutan alkohol 75% dan larutan asam cuka 24%. Persen massa adalah jumlah gram zat terlarut dalam 100 gram massa larutan. Persamaan yang menunjukkan perhitungan persen massa adalah sebagai berikut :
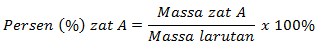
Hubungan Molalitas dengan Molaritas
Molaritas menyatakan jumlah mol zat terlarut dalam satu liter larutan. Molaritas dapat dikonversikan menjadi molalitas dengan merubah volume larutan menjadi massa larutan. Pengubahan volume menjadi massa membutuhkan data massa jenis larutan (p), yang dapat dirumuskan sebagai berikut:
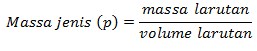
Fraksi Mol
Fraksi mol adalah suatu ukuran konsentrasi larutan yang menyatakan perbandingan dari jumlah mol pada sebagian zat terhadap jumlah keseluruhan mol yang ada dalam komponen larutan. Fraksi mol dibagi menjadi 2 bagian yaitu:
Fraksi mol zat terlarut (Xt)
Rumus fraksi mol zat terlarut (Xt), yaitu:
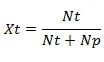
Keterangan:
Xt = fraksi mol zat terlarut
Nt = jumlah mol zat terlarut
Np = jumlah mol zat pelarut
Fraksi mol zat pelarut (Xp)
Rumus fraksi mol zat pelarut (Xp), yaitu:
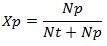
Keterangan
Xp = fraksi mol zat pelarut
Nt = jumlah mol zat terlarut
Np = jumlah mol zat pelarut
Jumlah fraksi mol zat terlarut dan zat pelarut adalah 1
Xt + Xp = 1
Contoh Soal Molalitas dan Penyelesainya
1. Berapakah molalitas larutan yang mengandung 8 gram NaOH (Ar Na = 23 gr/mol, Ar O = 16 g/mol, dan Ar H = 1 gr/mol) terlarut dalam 250 gr air?
Pembahasan
Diketahui:
Massa NaOH = 8 gr
Ar Na = 23 gr/mol
Ar O = 16 g/mol
Ar H = 1 gr/mol
massa air = 250 gr = 0,25 kg
Ditanya: Molalitas (m)….?
Jawab:
Mr.NaOH = 40 gr/mol
Jumlah mol NaOH = massa/Mr
Jumlah mol NaOH = 8 gr/(40 gr/mol)
Jumlah mol NaOH = 0,2 mol
m = jumlah mol/p
m = 0,2 mol /0,25 kg
m = 0,8 m
2. Tentukan molalitas larutan yang dibuat dengan melarutkan 15 gram urea CO(NH2)2 dalam 250 gram air.
Pembahasan
Diketahui:
Massa urea = 15 gr
Mr Urea= 60 g/mol
Massa pelarut = 250 gr = 0,25 kg
Ditanya: Molalitas (m)…. ?
Jawab:
Jumlah mol Urea = massa/Mr
Jumlah mol Urea = 15 gr / 60 g/mol
Jumlah mol Urea = 0,25 mol
m = jumlah mol/ massa pelarut
m = 0,25 mol /0,25 kg
m = 1 m
3. Berapakah molalitas dari larutan HCl 37% (w/w)? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Pembahasan
Diketahui:
massa HCl = 37%
Ar H = 1 g/mol
Ar Cl = 35,5 g/mol
Ditanya: Molalitas (m)…?
Jawab:
Mr.HCl = 36,5 gr/mol
Misalkan massa larutan adalah 100 gr maka massa HCl yaitu:
massa HCl = 37% x 100 gr
massa HCl = 37 gr
massa pelarut = massa larutan – massa HCl
massa pelarut = 100 gr – 37 gr
massa pelarut = 63 gr = 0,063 kg
jumlah mol HCl = massa/Mr
jumlah mol HCl = 37 gr /(36,5 gr/mol)
jumlah mol HCl = 1,01 mol
m = jumlah mol/ massa pelarut
m = 1,01 mol /0,063 kg
m = 16,03 m
4. Tentukan banyaknya (gram) NaOH yang harus dilarutkan dalam 1 liter air (air = 1,00 g/mL) agar diperoleh NaOH 0,25 m.
Pembahasan
Diketahui:
1 L air = 1.000 mL = 1.000 g (karena ρ air = 1,00 g/mL)
m NaOH = 0,25 m
Mr NaOh = 40
Ditanya: gr…?
Jawab:
m NaOH = gr / Mr x 1.000 / P
0,25 = gr/40 x 1.000/1.000
0,25 = g/40
g = 0,25 x 40
g = 10 gram
Jadi, banyaknya NaOH yang diperlukan adalah 10 gram.
5. Tentukan berapa mL volume air yang diperlukan untuk melarutkan 4,9 gram H2SO4 yang konsentrasinya 0,25 M (Ar H = 1; S = 32; O =16)!
Pembahasan
Diketahui:
m H2SO4 = 0,25
Mr H2SO4 = 98
gr = 4,9 gram
Ditanya: p..?
Jawab:
m = gr/Mr x 1.000/P
0,25 = 4,9/98 x 1.000/p
p = 20 gram (20 mL)
Jadi, volume air yaitu sebesar 20 mL.
Demikian pembahasan tentang “Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap” , semoga bermanfaat.
Artikel Paling Populer :
- Cara Pembuatan Koloid – Cara Kondensasi Dan Cara… Sistem koloid berada di antara larutan sejati dan suspensi. Jadi, susu merupakan koloid yang berada di antara larutan gula (larutan sejati) dan campuran air dengan pasir (suspensi). Oleh karena itu,…
- Pengertian, Rumus dan Contoh Soal Mol, Molalitas,… Pengertian, Rumus dan Contoh Soal Menghitung Mol, Molalitas, Molaritas, Normalitas, Part Per Million (ppm), Persen Massa dan Persen Volume Larutan Lengkap – Dalam kimia, ada beberapa satuan yang sering digunakan untuk…
- Kimia Analisis Ada yang sudah mengenal atau pernah mendengar mengenai istilah Kimia Analisis? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Kimia Analisis Kimia Analisis merupakan salah satu cabang ilmu Kimia yang mempelajari…
- PENURUNAN TEKANAN UAP LARUTAN Tekanan uap jenuh larutan adalah tekanan pada saat uap dan komponen larutan yang tidak menguap berada dalam kesetimbangan. Adanya zat terlarut dalam suatu pelarut dapat menyebabkan penurunan tekanan uap pelarut, sesuai dengan Hukum Raoult: ?P=Xt.PO?�=��.��…
- Faktor Faktor yang Mempengaruhi Pergeseran… Henry Louis Le Chatelier (1850-1936), ilmuwan kimia dari Prancis, pada tahun 1884 menyatakan bahwa ’’apabila dalam suatu kesetimbangan dilakukan tindakan (aksi) maka sistem kesetimbangan tersebut akan mengadakan reaksi sehingga pengaruh…
- Titik Didih Mendidih merupakan peristiwa yang tepat terjadi pada suatu zat ketika berubah wujud dari cair menjadi gas. Pernahkah kamu memanaskan air di dalam panci? Maka pada suhu tertentu akan timbul gelembung-gelembung…
- Pengertian Sel Elektrolisis, Kegunaan dan Contoh… Pengertian Sel Elektrolisis, Kegunaan atau manfaat dan Contoh Reaksi Sel Elektrolisis Terlengkap – Pada tahun 1989, terdapat dua ilmuwan mengumumkan bahwa mereka sudah mencapai “fusi dingin”, yaitu suatu proses fusi bersama…
- Pengertian, Cara Menentukan, Contoh Soal Rumus… Pengertian, Cara Menentukan, Contoh Soal Rumus Empiris dan Rumus Molekul Senyawa Lengkap – Rumus kimia merupakan salah satu ciri khas dari senyawa kimia. Rumus kimia terbagi menjadi 2 (dua) yaitu rumus…
- Sistem Dispersi Ada yang sudah mengenal atau pernah mendengar mengenai istilah Sistem Dispersi? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Sistem Dispersi Sistem dispersi merupakan salah satu campuran antara zatterlarut dan pelarut.…
- Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi… Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi Asam Basa Terlengkap – Tentu saja kita sering mendengar istilah asam basa dalam kimia. Kata asam berasal dari bahasa Latin acidu” yang berarti…
- Ikatan Ion : Pengertian, Ciri, Dan Syarat… Ikatan Ion : Pengertian, Ciri, Dan Syarat Terjadinya, Beserta Contohnya Lengkap – Tahukah anda apa yang dimaksud dengan ikatan ion ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada…
- Penjelasan Sistem Koloid Dan Sistem Dispersi Beserta… Es krim banyak disukai oleh tua dan muda karena rasanya yang lezat. Selain rasanya yang lezat, es krim mempunyai tekstur yang lembut dan beraneka rasa. Es krim dibuat dari campuran…
- Pengertian, Rumus dan Contoh Soal Molalitas dan… Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam…
- Hidrolisis Garam : Pengertian, Macam, Dan Rumus,… Karena pada kesempatan kali ini disini akan mengulas tentang pengertian Hidrolisis Garam, macam Hidrolisis Garam, dan rumus Hidrolisis Garam beserta contoh soalnya secara lengkap. Oleh karena itu marilah simak ulasan…
- Asam Basa – Mengkaji Dan Mengidentifikasi Sifat… Ketika makan buah jeruk, tentu ada sedikit atau mendominasi rasa masam dari buah jeruk. Rasa masam yang terdapat pada buah jeruk dikarenakan jeruk bersifat asam. Pernahkah Anda memperhatikan kaki atau…
- Sitoplasma Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Sitoplasma? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Sitoplasma Sitoplasma merupakan salah satu cairan pada sel yang terbungkus membran sel. Tiap-tiap…
- “Molalitas & Fraksi Mol” Pengertian & ( Contoh – Rumus ) Untuk pembahasan kali ini kami akan mengulas mengenai molalitas dan fraksi mol yang dimana dalam hal ini meliputi pengertian, contoh dan rumus, supaya lebih jelas dan dapat dipahami kalau begitu…
- Contoh Soal Kimia Dan Pembahasan Terlengkap Tentang… Setelah kita mempelajari tentang materi reaksi kesetimbangan pada postingan artikel sebelumnya, kali ini pembahasan selanjutnya mengenai soal tentang reaksi kesetimbangan. 1. Golongkan reaksi-reaksi berikut ke dalam reaksi homogen atau heterogen!…
- Kesetimbangan Kimia Ada yang sudah mengenal atau pernah mendengar mengenai Kesetimbangan Kimia? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Kesetimbangan Kimia Kesetimbangan Kimia merupakan salah satu bentuk reaksi bolak-balik yang mana laju…
- TEKANAN OSMOTIK TEKANAN OSMOTIK Osmosis adalah proses bergeraknya molekul pelarut dari larutan dengan konsentrasi lebih rendah ke yang lebih tinggi melalui membran semipermeable. Tekanan osmotik adalah tekanan hidrostatik yang dihasilkan dari proses osmosis, untuk mengimbangi tekanan dari…
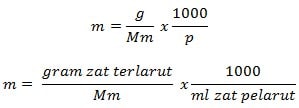
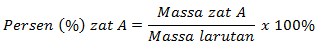
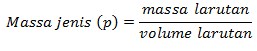
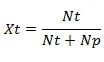
![]()