Guldberg dan Waage mengemukakan hukum kesetimbangan dalam reaksi kesetimbangan kimia sebagai berikut.
”Dalam keadaan setimbang pada suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi hasil kali konsentrasi pereaksi yang ada dalam sistem kesetimbangan yang masing-masing dipangkatkan dengan koefisiennya mempunyai harga tetap.”
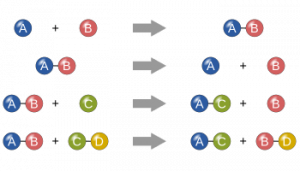
Terdapat jenis jenis Hubungan Kuantitatif Antara Pereaksi dan Hasil Reaksi terhadap kesetimbangan (K), untuk penjelasannya akan diuraikan dibawah ini.
Tetapan Kesetimbangan Berdasarkan Konsentrasi (Kc)
Pada tahun 1864, Cato Gulberg dan Peter Waage menemukan adanya suatu hubungan yang tetap antara konsentrasi komponen dalam kesetimbangan. Hubungan antara komponen dalam kesetimbangan tersebut diungkapkan dalam persamaan tetapan kesetimbangan (K). Oleh karena tetapan kesetimbangan ini didasarkan pada konsentrasi, dilambangkan dengan Kc.

Oleh karena satuan konsentrasi yaitu molar (M), satuan Kc diturunkan dari persamaannya menjadi Kc = M(r + s) – (P + q). Pada kesetimbangan heterogen, tetapan kesetimbangannya berasal dari komponen berfase gas atau larutan saja.
Harga tetapan kesetimbangan (K) beberapa reaksi kimia dapat dibandingkan satu sama lain. Bentuk hubungan tersebut adalah jika ada suatu reaksi yang tetapan kesetimbangannya sama dengan Kc, berlaku ketentuan berikut.
- Jika persamaan reaksi kesetimbangan dibalik, harga Kc juga dibalik =⅟kc
- Jika koefisien reaksi kesetimbangan dikalikan faktor x, harga Kc baru merupakan harga Kc lama dipangkatkan x atau Kcx.
- Jika koefisien reaksi kesetimbangan dibagi faktor y, harga Kc baru merupakan harga Kc lama diakar pangkat y.
- Jika reaksi-reaksi dijumlahkan, harga-harga Kc dikalikan.
Tetapan Kesetimbangan Tekanan Parsial (Kp)
Tetapan kesetimbangan berdasarkan tekanan parsial (Kp) yaitu hasil kali tekanan parsial gas-gas hasil reaksi dibagi dengan hasil kali tekanan parsial gas-gas reaktan setelah masing-masing dipangkatkan dengan koefisiennya menurut persamaan reaksi kesetimbangan.

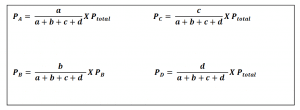
Jumlah tekanan parsial (P) masing-masing gas merupakan tekanan total (Ptotal) suatu campuran gas (PA , PB– Pc) dan Ptotal. sehingga Ptotal dapat dirumuskan:
Ptotal = PA + PB + PC + PD , satuan atm
Berdasarkan persamaan gas ideal, PV = nRT diketahui bahwa pada volume dan suhu tetap, tekanan parsial berbanding lurus dengan jumlah mol. Apabila gas mempunyai jumlah mol besar, tekanan parsial gas juga besar.

Jika pada contoh reaksi di atas, a, b, c, dan d merupakan mol gas A, B, C, dan D pada keadaan kesetimbangan, tekanan parsial setiap gas dapat dihitung dengan rumus berikut.
a. Hubungan Kc dengan Kp
Dari persamaan gas ideal:

b. Disosiasi
Disosiasi yaitu reaksi penguraian suatu zat menjadi zat yang lebih sederhana. Apabila disosiasi terjadi akibat pemanasan, disebut sebagai disosiasi termal. Dalam ruang tertutup disosiasi berakhir sebagai reaksi kesetimbangan sehingga disebut kesetimbangan disosiasi.
Contoh:
N2O4(g) ↔ 2NO2(g)
2NH3(g) ↔ N2(g) + 3H2(g)
I2 (g) ↔ 2l(g)
Demikian penjelasan yang bisa kami sampaikan tentang Jenis Jenis Hubungan Kuantitatif Antara Pereaksi dan Hasil Reaksi. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Karbon Monoksida: Pengertian, Struktur, Reaksi,… Dalam rumus kimia CO (karbon monoksida) merupakan gas yang tak berwarna, tak berasa, dan tak berbau. Ia terdiri dari satu atom yang kovelen yang berkaitana dengan satu atom oksigen. Dalam…
- Unsur, Senyawa dan Campuran Setiap hari kita sering menjumpai benda-benda yang mempunyai suatu bentuk, sifat, dan struktur penyusunnya yang beda-beda. Benda-benda tersebut ada yang dibentuk dari gabungan beberapa benda dan ada pula yang tidak…
- Makromolekul : Protein Kali ini kami akan membahas materi kimia tentang asam amino pada makromolekul. Protein Merupakan polimer alam yang tersusun dari asam-asam amino melalui ikatan peptida, sehingga protein juga disebut sebagai polipeptida.…
- Hubungan Kelarutan dengan Hasil Kali Kelarutan Dan… Pernahkah Anda melihat hasil foto rontgen usus? Mengapa organ pencernaan tersebut dapat terlihat jelas saat difoto rontgen? Seseorang yang akan melakukan foto rontgen organ pencernaan seperti usus dan lambung diharuskan…
- Unsur-Unsur Radioaktif Kali ini kami akan membahas tentang unsur-unsur radioaktif pelajaran kimia. Yuk, kita pelajari bersama-sama. Jenis Sinar Radioaktif Unsur radioaktif ialah unsur yang mempunyai inti atom tidak stabil dan bisa memancarkan sinar alfa, sinar…
- Pengertian Ekologi, Prinsip, Piramida, Jenis dan… Pengertian Ekologi, Prinsip, Piramida, Jenis dan Manfaat Ekologi Bagi Kehidupan Lengkap – Ekologi adalah ilmu yang mempelajari tentang interaksi antara organisme dan lingkungannya dan yang lainnya. Secara etimologi, Ekologi berasal…
- Asam Basa – Menghitung pH Larutan Asam Lemah dan Basa Lemah Asam lemah banyak terdapat dalam buah-buahan seperti mangga, apel, dan jeruk. Asam lemah tidak berbahaya dan boleh dimakan. Basa lemah, seperti aluminium hidroksida (AI(OH)3) dapat ditemukan dalam obat mag. pH…
- Termokimia Jadi termokimia apa sih? kita bakal ngebahas tentang sistem dan lingkungan, yuk langsung saja! Perubahan Entalpi Entalpi sendiri itu delta H, jadi perubahan energi pada suatu zat Ada dua jenis:…
- Pengertian, Hubungan Massa Dengan Dinamika Partikel… Pengertian Dinamika Partikel, Hubungan Massa Dengan Dinamika Partikel dan Jenis Gaya Dalam Dinamika Partikel Terlengkap – Dinamika partikel merupakan ilmu yang mempelajari tentang gaya-gaya yang megakibatkan suatu partikel yang pada…
- Pengertian Tenaga Eksogen, Jenis-Jenis dan Contoh… Pengertian Tenaga Endogen, Jenis-Jenis dan Contoh Tenaga Endogen Lengkap – Tenaga eksogen adalah tenaga yang berasal dari luar bumi yang bersifat merusak permukaan bumi yang dibentuk oleh tenaga endogen. Tenaga eksogen…
- Pengertian dan Cara Menghitung Kemolaran, Kemolalan… Pengertian dan Cara Menghitung Kemolaran, Kemolalan dan Kenormalan Larutan Lengkap – Molaritas adalah jumlah mol zat terlarut dalam 1 liter larutan atau 1 mmol zat terlarut dalam 1 ml larutan. Satuan…
- Fungsi Larutan Penyangga Dalam Tubuh Dan Kehidupan… Larutan penyangga sangat berperan dalam kehidupan makhluk hidup. Fungsi larutan penyangga dalam tubuh makhluk hidup dan dalam kehidupan sehari-hari sebagai berikut. Fungsi Larutan Penyangga dalam Tubuh Makhluk Hidup pH darah…
- Apa Pengertian Senyawa Mungkin kalian bingung dengan pengertian dari senyawa dan molekul. Apakah senyawa dan molekul memiliki definisi yang berbeda atau sama? Baiklah kita sekarang akan bahas terlebih dahulu tentang senyawa. Senyawa adalah zat yang…
- Pengertian dan Contoh Perubahan kimia Perubahan pada zat dibedakan menjadi dua yaitu perubahan fisika dan perubahan kimia. Untuk perubahan secara fisika sudah dibahas pada postingan sebelumnya yang berjudul "perubahan fisika". Pada postingan ini hanya dibahas mengenai perubahan…
- Pengertian, Bunyi, Rumus, Penerapan dan Contoh Soal… Pengertian, Bunyi, Rumus, Penerapan dan Contoh Soal Hukum Boyle Terlengkap – Hukum Boyle adalah hukum fisika yang menjelaskan tentang bagaimana kaitan antara tekanan dengan volume suatu gas. Penemu hukum boyle ini adalah Robert Boyle…
- Makalah Teori Indikator Asam Basa : Indikator, Ciri,… Air murni tidak mempunyai rasa, baud an warna. Bila mengandung zat tertentu, air dapat terasa asam, pahit, asin dan sebagainya. Air yang mengandung zat lain dapat pula menjadi berwarna. Kita…
- Berbagai Cara Penentuan Perubahan Entalpi Reaksi Dan… Perubahan entalpi reaksi (ΔH) dapat ditentukan dengan berbagai cara, yaitu menggunakan kalorimeter, data entalpi pembentukan standar, diagram tingkat energi (hukum Hess), dan energi ikatan.Dibawah ini akan kita jelaskan secara rinci…
- Asam Basa – Konsep pH, pOH, dan pKw Pada Larutan Asam Basa Kekuatan asam atau basa suatu larutan dapat ditentukan dari harga pH, pOH, dan pKw larutannya. Istilah pH digunakan untuk menyatakan keasaman atau kebasaan suatu larutan. Istilah pH berasal dari potential…
- Termokimia – Pengertian, Reaksi Termokimia dan… Termokimia adalah cabang ilmu kimia yang mempelajari tentang perubahan kalor atau energi yang menyertai suatu reaksi kimia, baik yang diserap maupun yang dilepaskan. Hukum kekekalan energi menyatakan bahwa energi tidak…
- Dinamika Gerak Rotasi : Pengertian, Rumus Dan… Dinamika Gerak Rotasi : Pengertian, Rumus Dan Pembahasan Contoh Soal – Aksi akrobat selalu menghadirkan decak kagum setiap orang yang menyaksikan. Atraksi yang sering dilakukan misalnya melipat tubuh dan menaiki roda yang…





