Perubahan entalpi reaksi (ΔH) dapat ditentukan dengan berbagai cara, yaitu menggunakan kalorimeter, data entalpi pembentukan standar, diagram tingkat energi (hukum Hess), dan energi ikatan.Dibawah ini akan kita jelaskan secara rinci tentang penentuan perubahan entalpi reaksi.
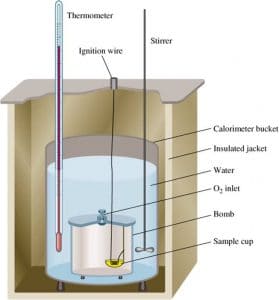
Penentuan ΔH Reaksi dengan Kalorimeter
Kalorimeter merupakan suatu sistem terisolasi sehingga tidak memungkinkan terjadinya pertukaran energi dan materi antara sistem dengan lingkungan. Oleh karena itu, kalorimeter dapat digunakan untuk menentukan jumlah kalor yang diserap oleh air dan perangkat kalorimeter. Semua kalor yang dilepaskan oleh sistem tidak ada yang terbuang ke lingkungan. Proses pengukuran kalor reaksi dengan kalorimeter dinamakan kalorimetri.
Rumus yang berlaku untuk menentukan besar (jumlah) kalor dalam kalorimeter:
q = m . C . AT Keterangan:
q = jumlah kalor (joule)
m = massa zat (g)
c = kalor jenis (Jg-1 °C-1)
ΔT = perubahan suhu (Takhir – Tawal)(°C)
Kalor jenis (c) merupakan jumlah kalor yang diperlukan untuk menaikkan 1 g zat sebesar 1 °C atau 1 K. Sementara itu, kapasitor panas (C) merupakan jumlah panas yang dibutuhkan untuk menaikkan suhu sebesar 1°C.
q = C • ΔT
ΔH = -q/mol
Keterangan:
q = jumlah kalor (joule)
C = kapasitas kalor (J°C_1)
ΔT = perubahan suhu (°C)
ΔH = perubahan entalpi
Penentuan ΔH Reaksi Berdasarkan Data Entalpi Pembentukan Standar (ΔH°f)
Penentuan harga perubahan entalpi reaksi (ΔHr) berdasarkan data entalpi pembentukan standar (ΔH°f) dihitung dengan cara menentukan selisih entalpi pembentukan standar (ΔH°f) antara produk dan reaktan, misal untuk reaksi berikut.

Penentuan ΔH Reaksi Berdasarkan Hukum Hess
Beberapa reaksi kimia ada yang berlangsung satu tahap ada yang berlangsung melalui beberapa tahap
dan tiap-tiap tahap memiliki sejumlah kalor tertentu.
Menurut Henry Hess, besarnya kalor reaksi (ΔH) suatu reaksi yang berlangsung beberapa tahap ditentukan sebagai berikut.
a. Apabila suatu reaksi dapat dinyatakan sebagai penjumlah aljabar, kalor reaksi juga merupakan penjumlah aljabar dari kalor yang menyertai reaksi-reaksi tersebut.
b. Kalor reaksi yang ditentukan/diserap tidak bergantung jalannya reaksi, tetapi bergantung pada kondisi zat-zat yang bereaksi dan zat-zat hasil reaksi.
Dengan demikian berlaku rumus hukum Hess:
∆H = ∆H1 + ∆H2 + ∆H3
Penentuan ΔH Reaksi Berdasarkan Energi Ikatan
Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan kimia dalam 1 mol suatu senyawa berwujud gas pada keadaan standar menjadi atom-atom penyusunnya. Berdasarkan jenis dan letak atom terhadap atom-atom lain dalam molekulnya, energi ikatan dibedakan menjadi tiga sebagai berikut.
a. Energi Atomisasi
Energi yang dibutuhkan untuk memutuskan semua ikatan dalam 1 mol molekul menjadi atom-atom bebas dalam keadaan gas.
b. Energi Disosiasi Ikatan
Energi yang dibutuhkan untuk memutuskan salah satu ikatan yang terdapat pada suatu molekul atau senyawa dalam keadaan gas.
c. Energi Ikatan Rata-Rata (D)
Energi rata-rata yang dibutuhkan untuk memutuskan ikatan atom-atom pada suatu senyawa.
Catatan: Suatu reaksi yang ditentukan ΔH-nya menggunakan energi ikatan, atom-atom yang terlibat dalam reaksi harus berwujud gas.
Demikian penjelasan yang bisa kami sampaikan tentang Berbagai Cara Penentuan Perubahan Entalpi Reaksi . Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Pengertian Teori Tumbukan dan Faktor-Faktor yang… Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna.…
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap Postingan sebelumnya admin telah membahas tuntas tentang Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi. Kali ini akan membahas macam-macam perubahan entalpi secara lengkap dengan penjelasannya. Perubahan entalpi yang menyertai suatu reaksi…
- Pengertian Lingkungan Hidup Alamiah dan Lingkungan… Penjelasan Lengkap Pengertian Lingkungan Hidup Alamiah dan Lingkungan Hidup Binaan Manusia hidup di muka bumi ini tidak sendirian, melainkan bersama makhluk hidup yang lain, yaitu tumbuhan, hewan, dan jasad renik.…
- Pengertian Ilmu Kimia Pengertian ilmu kimia, Sejarah, Cabang, Manfaat dan Sifat : Adalah ilmu yang mempelajari tentang komposisi, struktur, sifat dan perubahan dari suatu zat. Pengertian Ilmu Kimia Ilmu Kimia, berasal dari bahasa Arab,…
- Pengukuran Suhu Suhu adalah ukuran panas dan dinginnya suatu benda.Suhu diukur dengan bantuan alat yang disebut termometer. Tiga satuan suhu yang digunakan adalah Celcius, Fahrenheit, dan Kelvin. Setiap makluk hidup dapat merasakan…
- Pengertian Energi, Daya Listrik Dan Daya Elemen… Dalam kehidupan modern, listrik merupakan salah satu kebutuhan manusia. Banyak peralatan listrik yang kita gunakan dalam kehidupan sehari-hari. Di daerah yang belum terjangkau instalasi listrik pun telah memanfaatkan listrik. Misalnya,…
- Perubahan Kimia Perubahan kimia yang berhubungan dengan mudah sukarnya benda bereaksi kimia. Dalam kehidupan sehari-hari misalnya nasi yang menjadi basi karena terjadi adanya perubahan kimia. Untuk lebih jelas lagi mari simak ulasan…
- Pengertian dan Ciri-Ciri Mahkluk Hidup Beserta… Pengertian dan Ciri-Ciri Mahkluk Hidup Beserta Gambarnya Lengkap – Makhluk hidup adalah kumpulan molekul yang saling mempengaruhi sehingga berfungsi secara stabil dan bersifat hidup. Pengertian makhluk hidup secara umum, Makhluk…
- Penjelasan Lengkap tentang Katabolisme, Pengertian… Penjelasan Lengkap tentang Katabolisme, Pengertian dan Jenis Katabolisme Melanjutkan postingan sebelumnya seputar anabolisme dan enzim. Kali ini kita akan bahas tuntas mengenai katabolisme. Simak uraian berikut ini. Sebelum diserap oleh…
- Asam Basa – Penentuan pH Asam Kuat Dan Basa Kuat… Setelah kita mempelajari tentang pH, pOH, dan pKw, dikatakan bahwa Istilah pH digunakan untuk menyatakan keasaman atau kebasaan suatu larutan. Istilah pH berasal dari potential of hydrogen yang dikemukakan oleh…
- Kesetimbangan Kimia Ada yang sudah mengenal atau pernah mendengar mengenai Kesetimbangan Kimia? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Kesetimbangan Kimia Kesetimbangan Kimia merupakan salah satu bentuk reaksi bolak-balik yang mana laju…
- Pengertian Alkana, Tata Nama, Sifat, Kegunaan dan… Pengertian Alkana, Tata Nama, Sifat, Kegunaan dan Contoh Alkana Terlengkap – Senyawa hidrokarbon adalah senyawa yang mengandung unsur hidrogen dan karbon. Atom karbon selain dapat membentuk rantai karbon, juga bisa…
- Pengertian, Rumus dan Contoh Soal Perpindahan Kalor… Pengertian, Rumus dan Contoh Soal Perpindahan Kalor Secara Radiasi (Pancaran) Beserta Pemahaman Terlengkap – Jarak dari bumi ke matahari mencapai 149.600.000 km dan antara bumi dan matahari terdapat ruang hampa udara,…
- Unsur Oksigen Hai sobat hitung, bagaimana kabarnya? Semoga tetap sehat dan semangat ya… Nah, kali ini kami akan menjelaskan sedikit tentang materi kimia, yaitu mengenai unsur oksigen dan nitrogen. Harus kalian ketahui…
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi… Setiap reaksi yang berlangsung selalu melibatkan komponen-komponen berupa pereaksi, hasil reaksi, dan laju reaksi. Rada saat reaksi berlangsung, konsentrasi zat pereaksi dan zat hasil reaksi akan mengalami perubahan. Reaksi ada…
- Pengertian & Cabang-Cabang Ilmu Kimia Mendengar kata kimia, apalagi untuk pelajar SMA hal yang sangat menakutkan untuk didengar, karna pelajaran satu ini sangat membosankan dan sangat sulit untuk dipelajari, tapi tidak ada nama nya pelajaran…
- Pengertian Kalor – Kaparitas Kalor, Kalor Jenis,… Suatu bentuk energi yang dipindahkan melalui perbedaan suhu dinamakan kalor. Kalor dipindahkan/berpindah dari benda bersuhu tinggi ke benda bersuhu rendah. Besarnya kalor yang diserap atau dilepas oleh suatu benda berbanding…
- Pengertian dan Contoh Perubahan kimia Perubahan pada zat dibedakan menjadi dua yaitu perubahan fisika dan perubahan kimia. Untuk perubahan secara fisika sudah dibahas pada postingan sebelumnya yang berjudul "perubahan fisika". Pada postingan ini hanya dibahas mengenai perubahan…
- 5 Contoh Soal Kimia Dan Pembahasan Terlengkap… Telah kita pelajari tentang pengertan termokimia pada postingan sebelumnya. Bahwa Termokimia adalah cabang ilmu kimia yang mempelajari tentang perubahan kalor atau energi yang menyertai suatu reaksi kimia, baik yang diserap…
- Laju Reaksi Ada yang sudah mengenal atau pernah mendengar mengenai Laju Reaksi? Oke, mari simak penjelasan secara lengkapnya dibawah ini ya. Pengertian Laju Reaksi Laju Reaksi ialah sebuah laju penurunan ( reaktan atau…

