Materi atau zat dikelompokan menjadi zat tunggal (murni) dan campuran. Zat murni terdiri dari unsur dan senyawa. unsur merupakan zat murni yang paling sederhana. Sedangkan senyawa gabungan dari dua atau lebih unsur yang terbentuk melalui reaksi kimia. Suatu zat bisa berupa gas, cair, atau padat. Saat benda padat berubah menjadi cair, maka disebut meleleh atau melebur atau juga mencair.
Jika benda cair berubah menjadi padat, maka disebut menguap. Ada keunikan diantara zat tersebut. Ada beberapa zat yang sama yang juga dapat dijumpai dalam bentuk yang berbeda. Air bisa kita jumpai dalam bentuk gas (uap), cair (air), atau padat.
Pengertian Zat
Zat adalah sesuatu yang memiliki massa dan menempati ruang. Sedangkan wujud zat merupakan bentuk-bentuk berbeda yang diambil oleh berbagai fase materi berlainan.
Sifat-sifat partikel suatu zat adalah sebagai berikut :
- Partikel tidak diam, tetapi selalu bergerak atau bergetar
- Diantara satu partikel dengan partikel yang lain terdapat gaya tarik-menarik
- Diantara satu partikel dengan partikel yang lain terdapat ruang antarpartikel yang disebut pori-pori
Jenis-Jenis Wujud Zat
Wujud zat dikelompokkan menjadi 3, yaitu :
-
Zat Padat
Ciri zat padat yaitu bentuk dan volumenya tetap. Contohnya kelereng yang berbentuknya bulat, dipindahkan ke gelas akan tetap berbentuk bulat. Begitu pula dengan volumenya. Volume kelereng akan selalu tetap walaupun berpindah tempat ke dalam gelas. Hal ini disebabkan karena daya tarik antarpartikel zat padat sangat kuat. Pada umumnya zat padat berbentuk kristal (seperti gula pasir atau garam dapur) atau amorf (seperti kaca dan batu granit). Partikel zat padat memiliki sifat seperti berikut:
- Letaknya sangat berdekatan
- Susunannya teratur
- Gerakannya tidak bebas, hanya bergetar dan berputar di tempatnya
-
Zat Cair
Zat cair memiliki volume tetap tetapi bentuk berubah-ubah sesuai dengan yang ditempatinya. Apabila air dimasukkan ke dalam gelas, maka bentuknya seperti gelas, apabila dimasukkan ke dalam botol akan seperti botol. Tetapi volumenya selalu tetap. Hal ini disebabkan partikel-partikel penyusunnya agak berjauhan satu sama lain. Selain itu, partikelnya lebih bebas bergerak karena ikatan antar partikelnya lemah. Partikel zat cair memiliki sifat seperti berikut:
- Letaknya berdekatan
- Susunannya tidak teratur
- Gerakannya agak bebas, sehingga dapat bergeser dari tempatnya, tetapi tidak lepas dari kelompoknya
-
Zat Gas
Ciri dari gas di antaranya bentuk dan volume berubah sesuai dengan tempatnya. Gas yang terdapat di balon memiliki bentuk dan volume yang sama dengan balon. Gas yang terdapat di dalam botol, bentuk dan volumenya sama dengan botol. Partikel-partikel gas bergerak acak ke segala arah dengan kecepatan bergantung pada suhu gas, akibatnya volumenya selalu berubah. Partikel zat gas memiliki sifat seperti berikut:
- Letaknya sangat berjauhan
- Susunannya tidak teratur
- Gerakannya bebas bergerak, sehingga dapat bergeser dari tempatnya dan lepas dari kelompoknya, sehingga dapat memenuhi ruangan
Perubahan Wujud Zat
Perubahan wujud zat adalah perubahan termodinamika dari satu fase benda ke keadaan wujud zat yang lain. Perubahan wujud zat ini bisa terjadi karena peristiwa pelepasan dan penyerapan kalor. Perubahan wujud zat terjadi ketika titik tertentu tercapai oleh atom atau senyawa zat tersebut yang biasanya dikuantitaskan dalam angka suhu. Perubahan wujud zat dibedakan menjadi 2, yaitu :
-
Perubahan kimia
Perubahan yang menghasilkan zat baru Contoh : Makanan membusuk, pembakaran, petasan yang meledak, dan fermentasi.
-
Perubahan Fisika
Perubahan yang tidak menghasilkan zat baru yang berubah hanya wujud dan bentuknya. Contohnya : Es mencair, gula yang dilarutkan kedalam air, air menjadi es.
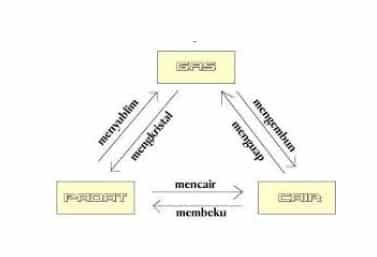
Perubahan fisika di bedakan menjadi 6 peristiwa, yaitu :
-
Membeku
Kejadian perubahan wujud zat dari cari ke padat. Dalam kejadian tersebut zat melepaskan energi panas. Misalnya kejadian mencair yakni air yang kita masukan kedalam freezer akan mencapai titik dingin dan menjadi es, lilin cair yang didinginkan.
Dalam ilmu kimia dan fiska, proses pembekuan yang terjadi ialah proses dimana cairan yang berubah menjadi padat. Titik beku adalah temperatur di mana hal tersebut terjadi. Perubahan merupakan suatu proses kejadian dari pembekuan dimana padatan berubah menjadi cair, pada sebagaian kejadian zat, titik beku dan titik lebur umumnya sama.
-
Mencair
Suatu kejadian perubahan wujud zat dari padat ke cair. Dalam peristiwa tersebut zat membutuhkan energi panas. Misalnya kejadian mencairnya batu es yang berubah menjadi air, lilin yang dipanaskan.
Peleburan atau pencairan ( terkadang disebut fusi) merupakan sebuahproses yang bisa menghasilkan perubahan fase dari padat ke cair. Energi internal zat padat meningkat (umumnya disebabkan panas) mencapai temperatur tertentu atau disebut titik leleh, pada saat zat tersebut menajdi cair, benda yang sudah mencair seutuhnya sebut juga sebagai benda cair.
-
Menguap
Kejadian dalam perubahan wujud zat dari cari ke gas. Dalam kejadian ini zat membutuhkan energi panas. Misalnya air yang direbus jika kita diamkan lama-lama akan habis, bensin yang dibiarkan pada tempat terbuka lama-kelaman akan habis dan berubah menjadi gas.
Uap merupakan gerakan refleks menghembuskan dan menark napas yang terjadi pada saat kita merasa mengantuk atau letih. Masih belum di ketahui sebab mengapa orang menguap, tapi sering dikatakan bahwa penyebabnya ialah jumlah oksigen di paru-paru yang rendah.
-
Mengembun
Suatu peristiwa perubahan wujud dari gas ke cair. Pada kejadian tersebut zat melepaskan energi panas. Misalnya mengembun ialah saat kita menyimpan sebuah es batu pada gelas maka bagian luar gelas akan menjadi basah, atau rumput yang ada dilapangan pada saat pagi hari mejadi basah padahal sore harinya tidak ada hujan.
Uap merupakan gerakan refleks menarik dan juga menghenbuskan napas yang terjadi pada saat kita merasa mengantuk atau letih. Belum diketahui sebabnya mengapa seseorang menguap, tatapi dikatakan bahawa penyebabnya ialah jumlah oksigen pada paru-paru dalam kondisi rendah.
-
Menyublim
Sebuah kejadian perubahan wujud zat dari padat ke cair. Dalam kejadian tersebut zat membutuhkan suatu energi panas. Misalnya menyublim yakni pada sebuah kamper atau sering kita sebut kapur barus, yang disimpan pada lemari pakaian lama-kelamaan akan habis.
Sublimasi merupakan perubahan wujud dari padat ke gas tanpa mencair dahulu. Contohnya es yang langsung menuap tanpa mecair dahulu. Pada kondisi tekanan normal, kebanyakan benda serta zat memiliki tiga bentuk yang bebeda – beda pada suhu yang berbeda-beda.
-
Mengkristal
Sebuah kejadian perubahan wujud dari gas ke padat. Dalam peristiwa tersebut zat melepaskan energi panas. Misalnya mengkristal ialah pada kejadian berubahnya uap menjadi salju.
Deposisi (fisika) atau Desublimasi merupakan sebuah proses pengkristalan diamana hal tersebut terjadi dikarenakan proses mengerasnya atau membekunya benda yang mempunyai zat-zat tertentu dan mempunyai sebuah unsur zat yang bisa memberikan warna pada saat mengeras dan bila dilihat seperti warna kristal. Hal tersebut ialah lawan dari Sublimasi.
Massa Jenis
Massa jenis adalah pengukuran massa setiap satuan volume benda. Semakin tinggi massa jenis suatu benda, maka semakin besar pula massa setiap volumenya. Massa jenis rata-rata setiap benda merupakan total massa dibagi dengan total volumenya. Sebuah benda yang memiliki massa jenis lebih tinggi (misalnya besi) akan memiliki volume yang lebih rendah daripada benda bermassa sama yang memiliki massa jenis lebih rendah (misalnya air).Satuan SImassa jenis adalah kilogramm per meterr kubik (kg·m-3).
Rumus Massa Jenis
Rumus untuk menentukan massa jenis adalah
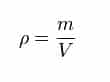
Ket :
ρ adalah massa jenis,
m adalah massa,
V adalah volume.
Adhesi dan Kohesi
Disamping terjadi interaksi antar molekul penyusun suatu zat, maka molekul penyusun suatu zat juga dapat bereaksi dengan molekul penyusun zat yang lainnya.Partikel-partikel zat padat dan partikel zat cair dapat mengadakan suatu ikatan, sehingga terjadi gaya tarik-menarik.
Cat dapat menempel pada kayu dan besi karena antara partikel-partikel cat dan partikel-partikel kayu atau besi terjadi gaya tarik-menarik. Peristiwa ini disebut adhesi. Dengan demikian, adhesi adalah gaya tarik-menarik antara partikel-partikel yang tidak sejenis. Contoh adhesi yaitu :
- Tinta dapat menempel di kertas
- Kapur / tinta dapat menempel di papan tulis
- Semen dapat melekatkan batu dengan pasir
- Cat dapat menempel pada tembok
Partikel-partikel yang sejenis dalam zat padat membentuk sutu ikatan yang sangat kuat sehingga membentuk benda padat. Di dalam kayu atau besi terjadi gaya tarik-menarik antarpartikel sehingga membentuk ikatan yang kuat. Demikian juga pada zat cair, dalam suatu zat ciri terjadi ikatan antarmolekul zat cair yang membentuk ikatan. Peristiwa ini disebut dengankohesi. Jadi, kohesi adalah gaya tarik-menarik antara partikel-partikel yang sejenis. Kohesi yang terjadi dalam zat padat lebih kuat disbanding kohesi dalam zat cair, itulah sebabnya molekul-molekul zat padat lebih sukar dipisahkan disbanding molekul-molekul zat cair. Sedangkan kohesi yang paling lemah terjadi pada gas, sehingga gas sangat untuk dipisahkan. Contoh kohesi yaitu :
- gaya tarik menarik antara molekul kayu membentuk kayu
- gaya tarik menarik antara molekuk kapur membentuk kapur batang
- gaya tarik menarik antara molekul-molekul gula membentuk butiran gula pasir
Pengaruh gaya adhesi dan kohesi terhadap zat cair menyebabkan terjadinya peristiwa-peristiwa sebagai berkut :
-
Meniskus cembung dan meniskus cekung

Jika adhesi lebih besar dari pada kohesi maka permukaan (meniskus) zat cair dalam pipa kapiler cekung, misalnya pada pipa yang diisi dengan air ( pipa kiri ). sebaliknya jika gaya kohesi lebih besar maka permukaan zat cair dalam pipa kapiler akan cembung, misalnya pipa yang diisi dengan air raksa ( pipa kanan).
Dalam kehidupan sehari-hari juga dapat dijumpai peristiwa adhesi dan kohesi, misalnya ketika ada air yang jatuh di atas permukaan daun tertentu akan membentuk bola air. Hal tersebut dikarenakan gaya kohesi lebih besar dari adhesi.
-
Kapilaritas
Kapilaritas adalah meresapnya zat cair melalui celah-celah sempit atau pipa rambut yang disering disebut sebagai pipa kapiler. Gejala ini disebabkan karena adanya gaya adhesi atau kohesi antara zat cair dan dinding celah tersebut. Zat cair yang dapat membasahi dinding kaca pipa kapiler memiliki gaya adhesi antara pipa kapiler dengan dinding pipa kapiler lebih besar. Sedangkan zat cair yang tidak membasahi dinding kaca pipa kapiler memilki gaya kohesi yang lebih besar. Hal ini akan mempengaruhi tinggi rendahnya permukaan zat cair pada pipa kapiler.
Contoh kapilaritas dalam kehidupan sehari-hari:
- Naiknya minyak tanah melalui sumbu kompor
- Naiknya minyak tanah melalui sumbu pada lampu tempel
- Baiknya air tanah sampai ke daun melalui pembuluh tapis
- Menetesnya air pada kain dalam ember yang semampai
Gaya antar molekul
Jika Molekul – molekul membentuk senyawa tentunya ada interaksi antar molekul tersebut. Dua diantaranya sekaligus disebut gaya tarik Van der Waals. Gaya tarik yang lemah disebabkan oleh dipol imbasan sesaat, yang terjadi antara semua molekul, bahkan juga molekul yang non polar sekalipun, Gaya tarik Van der Waals yang kuat, disebut gaya tarik dipol-dipol, terjadi antara molekul yang memiliki momen dipol permanen. Gaya tarik ketiga lebih kuat dari gaya Van der Waals yang terjadi hanya antar molekul tertentu dan kemudian disebut Ikatan Hidrogen. Gaya tarik antar molekul, mempengaruhi pemutusan ikatan, titik leleh maupun titik didih.
Gaya antar molekul dibagi menjadi dua, yaitu :
Gaya van der waals dapat terjadi pada molekul polar dan non polar. Pada molekul polar disebut gaya dipol, pada molekul non polar disebut gaya london atau gaya dispersi.Beberapa hal yang menyebabkan terjadinya ikatan Van Der Waals adalah sebagai berikut :
- Terjadi gaya tarik menarik antar molekul yang mempunyai perbedaan keelektronegativan meskipun muatannya kecil dan terdapat pada senyawa non polar. Contohnya : CH4
- Ikatan antar molekul yang memiliki perbedaan keelektronegatifan dengan molekul lain yang hampir tidak ada perbedaan keelektronegatifannya akan menginduksi molekul yang hampir tidak ada perbedaan keelektronegatifannya tersebut.
- Bila terjadi interaksi berbagai dipol secara bersamaan, maka akan menimbulkan gaya van der waals. Gaya van der walls mempengaruhi peningkatan titik didih unsur – unsur berwujud gas yang terletak pada golongan VIIIA dalam SPU.
Gaya Van Der Waals dibagi menjadi 2 yaitu, gaya dipol dan gaya London, Berikut penjelasannya :
-
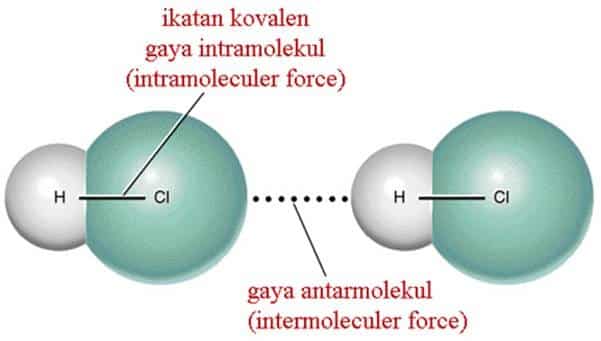
Gaya Dipol
Gaya dipol terjadi antar molekul polar. Dalam zat polar, molekul molekulnya cenderung menyusun diri dengan ujung (pol) positif berdekatan dengan ujung (pol) negatif dari molekul didekatnya.Di bawah ini contoh gaya dipol yang terjadi pada unsur HCl dan FCl :
-
Gaya London ( Dispersi )
Gaya London terjadi pada molekul – molekul non polar. Gaya ini terjadi padaunsur yang tidak mempunyai beda keelektronegatifan.Kekuatan gaya tarik dispersi bergantung pada seberapa banyak elektron yang berada untuk didispersikan. Semakinbesar ukuran molekul dan massa molarnya maka gaya tarik akan meningkat danmenyebabkan titik didih molekul semakin meningkat pula. Terjadi pada gas mulia dan unsur ringan. Contoh : N2, H2,O2,He2.
Contoh Perubahan Wujud Zat
Berikut ini terdapat beberapa contoh perubahan wujud zat, sebagai berikut:
- Perubahan wujud zat dari padat menjadi cair dinamakan mencair, misalnya es menjadi air; adalahproses menerima kalor.
- Perubahan wujud zat dari cair menjadi gas dinamakan menguap, misalnya air menjadi uap; adalahproses menerima kalor.
- Perubahan wujud zat dari gas menjadi padat dinamakan mengkristal, misalnya uap kapur barus menjadi butir-butiran kapur barus. Merupakan proses melepas kalor.
- Perubahan wujud zat dari padat menjadi gas dinamakan menyublim, misalnya kapur barus menjadi gas; adalahproses menerima kalor.
- Perubahan wujud zat dari gas menjadi cair dinamakan mengembun, misalnya pada destilasi air; adalahproses melepas kalor.
- Perubahan wujud zat dari cair menjadi padat dinamakan membeku, misalnya air menjadi es. Merupakan proses melepas kalor.