Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap – Kali ini kita aka membahas tentang pengertian dan rumus molaritas, pembuatan larutan dan pengenceran beserta dengan contoh soal dan penyelesaiannya. Berikut penjelasan selengkapnya:
A. Molaritas
Konsentrasi ialah jumlah zat terlarut yang hadir terhadap jumlah pelarut tertentu atau terhadap jumlah larutan tertentu. (Dalam hal ini kita dapat mengasumsikan zat terlarut berwujud cair atau padat, sedangkan pelarutnya berwujud zat cair) Konsentrasi bisa diungkapkan dengan berbagai cara, salah satunya yang paling sering dipakai, dan memang akan kita gunakan sekarang ini yaitu Molaritas (M), atau konsentrasi molar. Molaritas ialah jumlah mol terlarut setiap liter larutan. Atau bisa diungkapkan dengan menggunakan rumus:
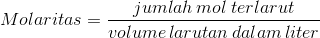
Atau bisa juga diungkapkan sebagai:
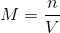
Dimana n menunjukan tentang jumlah mol zat terlarut (ingat ya zat terlarut) dan V menunjukan tentang volume larutan dalam liter (jangan lupa larutan dalam liter). Nah apabila yang diketahuinya bukan mol tapi melainkan gram zat terlarut, rumus tadi dapat juga diungkapkan dengan:
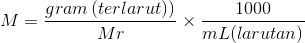
Satu lagi, apabila yang diketahui adalah massa jenis larutan (ρ) dan kadar atau persen massa (%), maka Molaritas bisa dicari dengan menggunakan rumus seperti:
Contoh:
1,46 molar larutan Glukosa (C6H12O6), ditulis dengan 1,46 M C6H12O6, yang artinya adalah mengandung 1,46 mol zat terlarut (C6H12O6) di dalam1 liter larutan (pelarut+terlarut). Tentu saja dalam hal ini volumenya tidak harus 1 liter, yang penting perbandingannya sama. Misalnya apabila volume larutan 500 mL (0,5L), maka C6H12O6 yang terlarut yaitu sebanyak 0,73 mol.
B. Pembuatan larutan
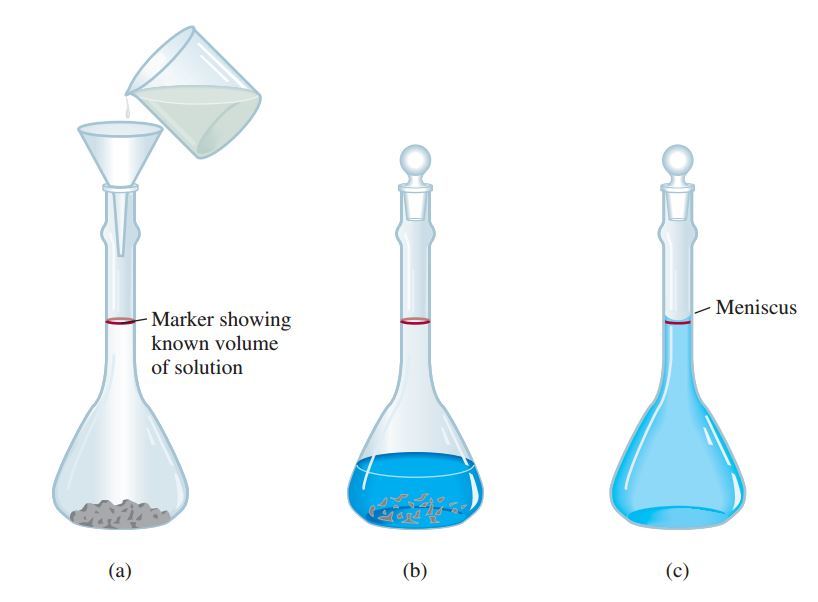
“masukan terlebih dahulu padatan, kemudian isi sedikit air. setelah larut baru tambahkan lagi air sampai batas garis”
Untuk membuat suatu larutan, yang tentunya nanti berhubungan langsung dengan molaritas. Langkah pertama yaitu memasukan zat terlarut yang sudah ditimbang terlebih dahulu (biasanya dalam bentuk padatan dengan massa dalam ukuran gram) ke dalam labu ukur melalui sebuah corong. Langkah selanjutnya adalah menambahkan sedikit air ke dalam labu ukur dengan perlahan hingga zat terlarut melarut sambil digoyang-goyangkan. Setelah zat terlarut tersebut sepenuhnya melarut, selanjutnya yaitu tambahkan sedikit demi sedikit air, dan jangan sampai melewati garis batas yang ada di labu ukur.
Dengan mengetahui suatu volume larutan yang dimasukkan ke dalam labu ukur, dan juga mengetahui jumlah dari zat terlarut (biasanya diukur dalam gram, sehingga nantinya biasa dirubah ke satu mol dengan rumus mol=gram/Mr) maka kita akan bisa menghitung Molaritas larutan tersebut.
C. Pengenceran
Seringkali larutan dibuat dan disimpan di dalam laboratorium dengan konsentrasi yang tinggi sebagai larutan ‘stok’. Hal ini akan lebih menghemat waktu daripada harus selalu membuat larutan setiap praktikum. Larutan ‘stok’ ini nantinya tinggal diambil sedikit, yang kemudian diencerkan sehingga konsentrasinya menjadi lebih kecil sesuai dengan kebutuhan. Oleh karena itu kita harus mengetahui cara mengencerkan larutan tersebut.
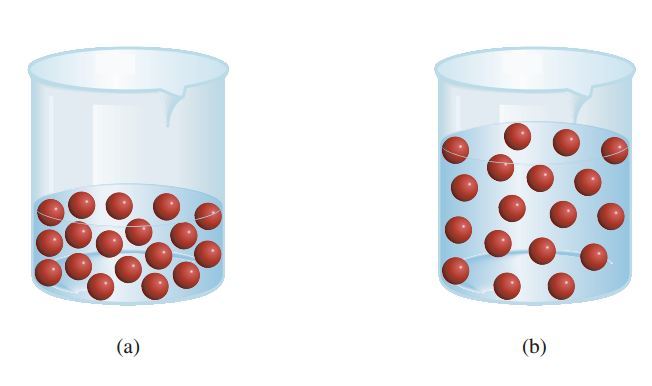
“(a) sebelum diencerkan, (b) seseudah diencerkan”
Ketika dilakukan sebuah pengenceran, sebenarnya jumlah mol zat terlarut tidaklah berubah, melainkan yang mengalami perubahan hanyalah volumenya saja. Mari kita lihat ilustrasinya
Jika terdapat 18 molekul terlarut sebelum diencerkan, maka ketika ditambahkan air, jumlah si molekul terlarut ini tidak akan berubah bukan? Ya tetap jumlahnya akan 18 molekul. Begitu juga dengan jumlah mol, tidak akan berubah. Sehingga, akan berlaku
nsebelum pengenceran = nsesudah pengenceran
dan berdasarkan rumus molaritas sebelumnya, dimana n =M.V, maka:
n1 = n2
M1 V1 = M2 V2
Dimana M1 adalah konsentrasi awal sebelum pengenceran dan M2 adalah kkonsentrasi larutan sesudah pengenceran.
Contoh soal
Berapakah Volume dari larutan H2SO4 2 M yang dibutuhkan untuk membuat larutan 200 mL H2SO4 0,5 M?
Jawab:
M1= 2 M, V1 = …?
M2 = 0,5 M, V2 = 200 mL
Maka:
M1 V1 = M2 V2
2 . V1 = 0,5 . 200
V1 = 50 mL
Demikian pembahasan tentang”Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap” , semoga bermanfaat.
Artikel Paling Populer :
- Pengertian, Rumus dan Contoh Soal Molalitas dan… Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap – Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam…
- Penerapan Operasi Hitung Bilangan Bulat operasi hitung pada bilangan bulat yang meliputi operasi penjumlahan, operasi pengurangan, operasi perkalian dan oprasi pembagian. Semua operasi tersebut sekarang kita terapkan pada contoh soal untuk menyelesaikan masalah yang berkaitan dengan kehidupan sehari-hari. Berikut contoh…
- Unsur, Senyawa dan Campuran Setiap hari kita sering menjumpai benda-benda yang mempunyai suatu bentuk, sifat, dan struktur penyusunnya yang beda-beda. Benda-benda tersebut ada yang dibentuk dari gabungan beberapa benda dan ada pula yang tidak…
- Rumus Tabung : Volume, Luas Permukaan, Keliling,… Rumus Tabung : Volume, Luas Permukaan, Keliling, Tinggi dan Contoh Soal Tabung – Dalam matematika kita mempelajari tentang bangun ruang. Bangun ruang adalah sebuah penamaan atau sebutan untuk beberapa bangun-bangun yang berbentuk tiga…
- Filtrasi Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Filtrasi? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Filtrasi Filtrasi merupakan salah satu metode atau sebuah cara pemisahan secara fisik atau…
- Pengertian Satuan Kuantitas dan Contoh Soal Satuan… Pengertian Satuan Kuantitas dan Contoh Soal Satuan Kuantitas Beserta Pembahasannya Lengkap – Dalam kehidupan sehari-hari kalian pasti pernah mendengar beberapa istilah seperti Lusin, Gross, Rim, dan Kodi. Dalam matematika istilah tersebut…
- Kromatografi Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Kromatografi? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Kromatografi Kromatografi merupakan suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan antara fase…
- Pengertian Gaya Berat, Rumus dan Contoh Soal Gaya… Pengertian Gaya Berat, Rumus dan Contoh Soal Gaya Berat Beserta Cara Penyelesaiannya Terlengkap – Dalam kehidupan sehari-hari, kita sering menggunakan gaya berat salah satu contohnya adalah saat kita menimbang barang.…
- Prinsip Kerja Larutan Penyangga Dan Sifat – Sifat… Lensa kontak sering digunakan sebagai pengganti kacamata atau sekadar untuk mempercantik penampilan. Lensa kontak tidak dapat digunakan secara sembarangan. Lensa kontak mempunyai pH tertentu yang tidak boleh berubah. pH lensa…
- Ikatan Kovalen Ada yang sudah mengenal atau pernah mendengar mengenai Ikatan Kovalen? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Ikatan Kovalen Ikatan Kovalen merupakan salah satu ikatan yang terbentuk karena pemakaian dari…
- Pengertian, Rumus dan Contoh Soal Listrik Dinamis… Pengertian, Rumus dan Contoh Soal Listrik Dinamis Beserta Cara Penyelesaian Lengkap – Listrik dinamis (electronidinamic) berasal dari perpaduan kata listrik dan dinamis. Listris adalah listrik, sedangkan dinamis yaitu berubah-ubah atau bergerak.…
- Difusi Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Difusi? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Difusi Difusi merupakan salah satu peristiwa zat yang ada didalam pelarut berpindah atau…
- Pengertian Sublimasi, Tujuan Sublimasi dan Contoh Sublimasi Pengertian Sublimasi, Tujuan Sublimasi dan Contoh Sublimasi Secara Lengkap Dalam suatu zat kimia terjadi berbagai proses, seperti padat menjadi cair, cair menjadi padat, cair menjadi gas, gas menjadi padat dan…
- Pengertian, Rumus dan Contoh Soal Listrik Dinamis… Pengertian, Rumus dan Contoh Soal Listrik Dinamis Beserta Cara Penyelesaian Lengkap – Listrik dinamis (electronidinamic) berasal dari perpaduan kata listrik dan dinamis. Listris adalah listrik, sedangkan dinamis yaitu berubah-ubah atau bergerak.…
- Faktor Faktor yang Mempengaruhi Pergeseran… Henry Louis Le Chatelier (1850-1936), ilmuwan kimia dari Prancis, pada tahun 1884 menyatakan bahwa ’’apabila dalam suatu kesetimbangan dilakukan tindakan (aksi) maka sistem kesetimbangan tersebut akan mengadakan reaksi sehingga pengaruh…
- Cara Menentukan dan Menghitung Rumus Luas dan… Mengetahui Rumus hitung Luas dan Keliling Pada Trapesium Lengkap dengan Contoh Soal dan Pembahasannya Trapesium merupakan bangun datar dua dmensi yang dibentuk oleh empat buah rusuk yang dua diantara rusuknya…
- “Molalitas & Fraksi Mol” Pengertian & ( Contoh – Rumus ) Untuk pembahasan kali ini kami akan mengulas mengenai molalitas dan fraksi mol yang dimana dalam hal ini meliputi pengertian, contoh dan rumus, supaya lebih jelas dan dapat dipahami kalau begitu…
- Cara Menggunakan Fungsi SUMIF dan SUMIFS pada Excel… Cara Menggunakan Fungsi SUMIF dan SUMIFS pada Excel Lengkap dengan Rumus dan Contohnya Pada postingan sebleumnya, kita telah membahas tentang kegunaan masing-masing dari microsoft Office. Salah satu nya yaitu Microsoft Excel.…
- Titik Didih Mendidih merupakan peristiwa yang tepat terjadi pada suatu zat ketika berubah wujud dari cair menjadi gas. Pernahkah kamu memanaskan air di dalam panci? Maka pada suhu tertentu akan timbul gelembung-gelembung…
- Kesetimbangan Kimia Ada yang sudah mengenal atau pernah mendengar mengenai Kesetimbangan Kimia? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Kesetimbangan Kimia Kesetimbangan Kimia merupakan salah satu bentuk reaksi bolak-balik yang mana laju…
![]()
![]()
![]()

