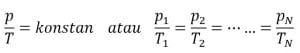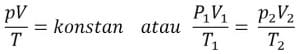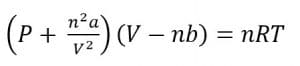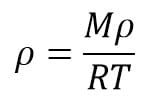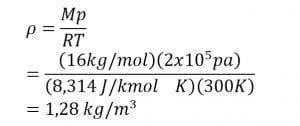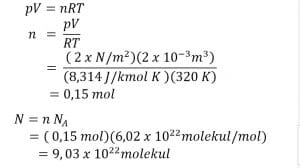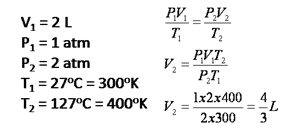Pernahkah Anda melihat gelembung-gelembung ketika minuman bersoda dituangkan? Bagaimana bentuk dan jumlahnya? Gelembung-gelembung minuman bersoda merupakan inti molekul-molekul. Gelembung-gelembung minuman bersoda akan berjumlah banyak dan volumenya semakin membesar saat dituangkan. Hal ini dikarenakan adanya pengaruh tekanan dan jumlah mol dalam minuman tersebut. Fenomena ini merupakan contoh keseharian dari teori kinetik gas. Kita akan memperdalam pembahasannya pada artikel kali ini.

Persamaan Umum Gas
Hukum dari Persamaan Keadaan Gas Ideal
Gas ideal (sempurna) merupakan gas yang tenaga ikat antarmolekulnya dapat diabaikan. Kaidah- kaidah atau hukum-hukum yang menjelaskan tentang hal itu, dijelaskan sebagai berikut.
a. Hukum Boyle
Dalam sebuah sistem tertutup dan bersuhu konstan, besar tekanan gas akan berbanding terbalik dengan besarnya volume. Sistem dapat berupa ruangan, tabung, dan balon.
Rumus:
pV = konstan atau P1 V1 = p2 V2 = . . . = pN VN
b. Hukum Charles
Jika tekanan gas yang berada dalam bejana tertutup dijaga tetap, temperatur (suhu) mutlak gas sebanding dengan volumenya.
Rumus :
c. Hukum Gay-Lussac
Dalam sebuah sistem yang volume gas di dalamnya konstan (tetap), besarnya suhu mutlak gas sebanding dengan tekanannya.
Rumus:
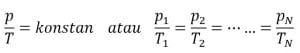
d. Persamaan Umum Gas Ideal
Penyatuan persamaan hukum Boyle, hukum Charles, dan hukum Gay-Lussac dikenal dengan persamaan umum gas ideal.
Rumus:
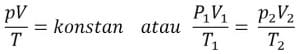
Persamaan Keadaan Gas Real
Persamaan keadaan gas Van der Waals: ”Jika gaya ikat antarmolekul tersebut diperhitungkan, diperlukan koreksi terhadap persamaan gas ideal”.
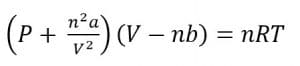
Penerapan Hukum-Hukum Gas Ideal pada Persoalan Fisika Sehari-hari
Berikut ini beberapa contoh penerapan hukum-hukum gas ideal dalam kehidupan sehari-hari.
a. Ban atau Balon Dapat Meletus di Bawah Terik Sinar Matahari
Sepeda yang diparkir saat matahari terik, gas di dalam ban akan mengalami kenaikan suhu. Jika suhu gas di dalam ban meningkat maka tekanan gas dalam ban juga akan naik. Lama-kelamaan J ban tersebut tidak dapat menahan tekanan gas sehingga ban meletus.
b. Gelembung pada Minuman Bersoda
Pada minuman bersoda yang dituang ke dalam gelas, akan tampak adanya gelembung- gelembung udara. Gelembung tersebut merupakan inti molekul-molekul C02. Ketika minuman dituangkan, temperatur relatif tetap. Namun, tekanan hidrostatis minuman bersoda saat dituang di dalam gelas sedikit berubah. Oleh karena itu, gelembung yang naik dari dasar permukaan minuman semakin besar.
c. Balon Udara Panas Dapat Mengudara
Balon udara bekerja berdasarkan pemuaian udara akibat pemanasan. Pemanasan pada balon dapat meningkatkan suhu udara dalam balon. Pemanasan tersebut juga menyebabkan volume dan tekanan gas berubah. Udara yang memuai menyebabkan massajenis udara dalam balon mengecil, nilainya lebih kecil dari massa jenis udara iuar, akjbatnya balon akan naik ke udara.
Rmus yang berlaku:
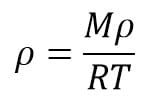
Contoh Soal !
1. Tentukan massa jenis gas 02 (M = 16 kg/kmol) pada suhu 27°C dan tekanan 2 atm!
Penyelesaian:
Diketahui:
Mo2 =16 kg/kmol
T 2 = 27 + 273 = 300 K
p =2 atm = 2 x 105 Pa
R =8.314 J/kmol K
Ditanyakan: r
Jawab:
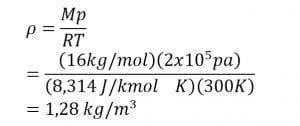
Jadi, massa jenis gas sebesar 1,28 kg/m2
2. Gas pada ruang tertutup mempunyai tekanan 2 atm dan volumenya 2 liter. Tentukan banyaknya partikel gas pada suhu 47°C!
Penyelesaian:
Diketahui :
P = 2 atm = a x 105 N/m2
V = 2 liter = 2 x 10-3 m3
T = 47 + 273 = 320 K
Ditanyakan : N
Jawab :
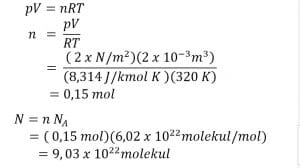
Jadi, banyaknya partikel gas pada suhu 47°C sebesar 9,03 x 1022 molekul.
3. Sebuah bejana berisi gas He yang memiliki volume 2 L, tekanan 1 atm dan suhunya 27`C. apabila suhunya dinaikkan menjadi 127`C dan ternyata tekanannya naik 2 kalinya. Hitunglah volumenya!
Cara Penyelesaian:
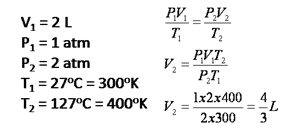
Terdapat sebuah tangki bervolume 3000 cm3 berisi gas O2 pada suhu 20`C dan tekanan relatif pada alat 25 atm. apabila massa molar O2=32 kg/kmol, tekanan udara luar 1 atm, jadi berapakah massa O2 yang ada di dalam tangki tersebut ?
Cara penyelesaian:

Demikian penjelasan yang bisa kami sampaikan tentang Teori Kinetik Gas – Persamaan Umum Gas, Hukum Gas Ideal Dan Pembahasan Contoh Soal. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Gaya Berat Pada kesempatan kali ini akan membahas tentang pengertian gaya berat, rumus gaya berat, dan contoh gaya berat. Untuk itu marialh simak ulasan yang ada dibawah berikut ini. Pengertian Gaya Berat…
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap Postingan sebelumnya admin telah membahas tuntas tentang Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi. Kali ini akan membahas macam-macam perubahan entalpi secara lengkap dengan penjelasannya. Perubahan entalpi yang menyertai suatu reaksi…
- Pengertian Reaksi Kimia, Kesetimbangan Kimia, dan… Pernahkah Anda mengamati keadaan gua? Pada umumnya, keadaan di dalam gua adalah lembap, banyak tetesan air, stalaktit, dan stalakmit. Stalaktit dan stalakmit terbentuk dari endapan mineral kalsium karbonat (CaCO3). Endapan…
- Termokimia – Pengertian, Reaksi Termokimia dan… Termokimia adalah cabang ilmu kimia yang mempelajari tentang perubahan kalor atau energi yang menyertai suatu reaksi kimia, baik yang diserap maupun yang dilepaskan. Hukum kekekalan energi menyatakan bahwa energi tidak…
- Materi Termodinamika Ada yang sudah mengenal atau pernah mendengar mengenai istilah Termodinamika? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Termodinamika Kata Termodinamika ini bersalah dari bahasa Yunani yaitu “Thermos” yaitu “Panas” dan…
- Himpunan Penyelesaian Persamaan Linear Satu Variabel Sebelumnya sudah dibahas bahwa kalimat terbuka yang dihubungkan oleh tanda sama dengan (=) disebut persamaan, sedangkan persamaan dengan satu variabel berpangkat satu atau berderajat satu disebut persamaan linear satu variabel. Bagaimana cara menentukan…
- Pengertian Sorbitol dan Apa Dampak yang Ditimbulkan? pengertian sorbitol adalah sebuah gula alkohol dengan 4 kalori per gram. Nama “sorbitol” berasal dari Sorbus, nama ilmiah untuk sejenis genus dari tumbuh-tumbuhan. Tumbuhan-tumbuhan bergenus sorbus inilah yang menghasilkan sorbitol. Tumbuhan lain…
- Pengertian, Konsep, Rumus dan Contoh Penerapan Hukum… Pengertian, Konsep, Bunyi, Rumus dan Contoh Penerapan Hukum Archimedes Terlengkap – Hukum archimedes ditemukan oleh ilmuwan yang berasal dari Yunani pada tahun 187-212 SM yang bernama Archimedes. Archimedes adalah seorang penemu…
- Hukum Kekekalan Energi Ada yang sudah mengenal atau pernah mendengar mengenai Hukum Kekekalan Energi? Oke, mari simak penjelasan secara lengkapnya dibawah ini ya. Pengertian Hukum Kekekalan Energi Hukum Kekekalan Energi merupakan suatu hukum yang…
- Gaya Gesek Untuk yang belum mengetahui apa itu gaya gesek disini akan mengulas tentang pengertian gaya gesek, rumus gaya gesek, dan contoh soalnya secara lengkap sebagai bahan refrensi anda. Oleh karena itu…
- Pengertian Teori Tumbukan dan Faktor-Faktor yang… Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna.…
- Penyelesaian PLSV dengan Persamaan-Persamaan yang Ekuivalen Sebelumnya kami sudah dibahas tentang cara penyelesain persamaan linear satu variabel dengan cara substitusi (penggantian). Cara itu kelihatan agak ribet karena harus mencoba satu persatu suatu bilangan yang jumlahnya tidak terhingga.…
- Mempelajari Sistem Persamaan Linier Dan Metode… Sistem persamaan linier sebenarnya hampir sama dengan persamaan aljabar, yakni sebuah sistem penghitungan yang menggunakan metode matematika dan juga dapat di gambarkan dengan menggunakan bentuk garis lurus dalam sebuah grafik.…
- Penyelesaian Persamaan Linear Satu Variabel Bentuk Pecahan Dalam menyelesaikan persamaan linear satu variabel (PLSV) yang berbentuk pecahan caranya hampir sama seperti mengerjakan PLSV yang bentuknya bukan pecahan yang sudah dibahas pada postingan sebelumnya dan tetnunya cara tersebut hampir sama…
- Pengertian, Rumus dan Bunyi Kirchhof 1 dan 2 Lengkap Pengertian, Rumus dan Bunyi Kirchhof 1 dan 2 Lengkap Dalam Ilmu Fisika Hukum kirchhoff merupakan salah satu hukum dalam ilmu elektronika yang berfungsi untuk menganalisis arus dan tegangan dalam sebuah…
- Fisika Inti Dan Radioativitas – 11 Inti Induk dan… Penjelasan Lengkap Materi Fisika Inti Dan Radioativitas – 11 Inti Induk dan Inti Baru radioaktivitas Beserta Rumus Soal Di dalam inti atom terdapat proton dan netron. Proton – proton dalam inti…
- Pengertian, Bunyi, Rumus, Penerapan dan Contoh Soal… Pengertian, Bunyi, Rumus, Penerapan dan Contoh Soal Hukum Pascal Terlengkap – Hukum Pascal berbunyi: “jika tekanan yang diberikan pada satu bagian zat cair dalam suatu ruangan tertutup, maka akan diteruskan oleh…
- Hukum Pascal Hukum Pascal beserta bunyi dan rumusnya secara lengkap. Apa yang kamu ketahu mengenai Hukum Pascal ? Jika kamu ingin mengetahuinya lebih dalam lagi mengenai Hukum Pascal dikehidupan sehari-hari kamu, mari…
- Hukum Ohm – Pengertian,Rumus Ohm Dan Bunyi Hukum Ohm Hukum Ohm merupakan suatu pernyataan bahwa besar arus listrik yang mengalir melalui sebuah penghantar selalu berbanding lurus dengan beda potensial yang diterapkan kepadanya. Sebuah benda penghantar dikatakan mematuhi hukum Ohm apabila…
- Berbagai Bentuk Molekul, Pengertian Teori Domain… Setiap molekul yang tersusun dari atom unsur tertentu dengan jumlah yang tertentu pula akan mempunyai bentuk molekul tertentu. Bentuk molekul merupakan bentuk geometris yang terjadi jika inti atom unsur yang…