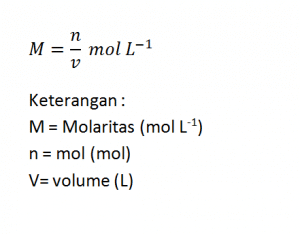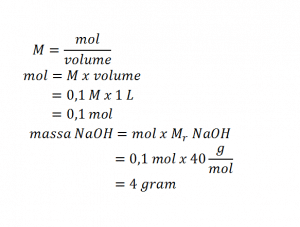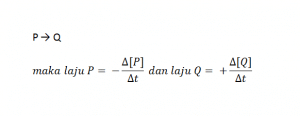Setiap reaksi yang berlangsung selalu melibatkan komponen-komponen berupa pereaksi, hasil reaksi, dan laju reaksi. Rada saat reaksi berlangsung, konsentrasi zat pereaksi dan zat hasil reaksi akan mengalami perubahan. Reaksi ada yang berlangsung cepat tetapi ada juga yang berlangsung lambat. Cepat lambatnya reaksi dipengaruhi oleh banyak faktor, di antaranya konsentrasi zat-zat yang bereaksi. Konsentrasi zat yang terlibat dalam reaksi ini menggunakan satuan molaritas (M).

Kemolaran (M)
Kemolaran atau molaritas yaitu banyaknya mol zat terlarut dalam satu liter larutan. Perumusan molaritas sebagai berikut.
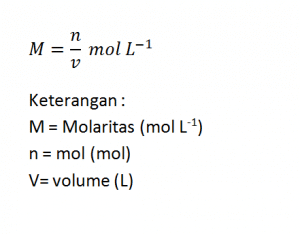
Larutan dengan molaritas tertentu dapat dibuat dari padatan murni atau larutan pekatnya. Membuat larutan dari padatan murni dilakukan dengan melarutkan padatan murni dengan jumlah tertentu ke dalam satu liter pelarut. Misal, akan membuat 1 liter larutan NaOH 0,1 M dari kristal NaOH. Langkah- langkah yang harus dilakukan sebagai berikut.
- Menyiapkan alat dan bahan yang digunakan yaitu kristal NaOH, labu ukur 1 L, akuades, neraca, pipet foks, dan sendok stainless steel.
- Menghitung massa NaOH yang diperlukan dari konsentrasi yang diinginkan.
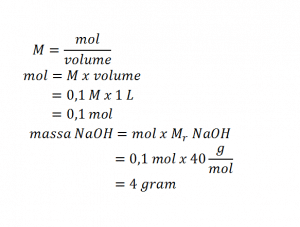
- Menimbang 4 gram kristal NaOH.
- Mengisi labu ukur dengan akuades, sebanyak volume yang diinginkan.
- Melarutkan kristal NaOH ke dalam akuades dalam labu, tambahkan air hingga batas tanda 1 L, kocok hingga kristal NaOH larut sempurna.
Sementara itu, untuk membuat larutan dengan konsentrasi tertentu dari larutan pekatnya dapat dilakukan dengan cara pengenceran menggunakan rumus berikut.

Jika diketahui kadar dan massa jenisnya, penentuan molaritas menggunakan rumus berikut ini:

Sememntara itu, untuk molarits campuran larutan dapat dihitung menggunakan rumus berikut:

Pengertian Laju Reaksi (v)
Laju reaksi menyatakan ukuran seberapa cepat atau lambat suatu reaksi berlangsung. Jika ditinjau dari waktu berlangsungnya reaksi, reaksi kimia ada yang berlangsung cepat dan ada yang berlangsung lambat.
Pembakaran kembang api merupakan contoh reaksi yang berlangsung cepat. Sementara itu, proses pematangan buah memerlukan waktu yang lama sehingga reaksi kimia tersebut termasuk reaksi yang berlangsung lambat.
Laju reaksi didefinisikan sebagai perubahan konsentrasi reaktan atau produk setiap satuan waktu. Laju reaksi dirumuskan sebagai berikut.

Grafik konsentrasi pereaksi dan konsentrasi produk terhadap waktu sebagai berikut:
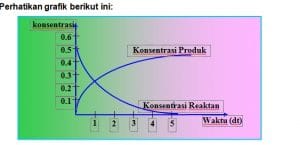
Jika diketahui persamaasn reaksi:
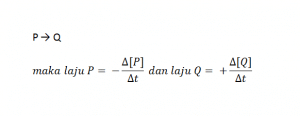
Δ[P] dan Δ[Q] merupakan konsentrasi dalam satuan molar pada periode waktu Δt. Δ[P] diberi tanda negatif karena konsentrasi P berkurang. Sebaliknya,Δ[Q] diberi tanda positif karena konsentrasi Q bertambah. Secara umum laju reaksi dirumuskan sebagai berikut.

Pada reaksi yang lebih kompieks, diperlukan kehati-hatian dalam menuliskan persamaan laju reaksinya. Misal, untuk reaksi 2A → B. Pada reaksi tersebut, dua mol A diperlukan untuk menghasilkan satu mol B. Ini berarti bahwa laju berkurangnya A dua kali lebih cepatdari laju pembentukan B. Dengan demikian, laju reaksinya dituliskan sebagai berikut.

Catatan:
Tanda positif menunjukkan penambahan jumlah produk, sedangkan tanda negatif menunjukkan pengurangan jumlah reaktan.
Persamaan Laju Reaksi dan Orde Reaksi
Gulberg dan Waage merumuskan hubungan kuantitatif antara konsentrasi zat-zat yang bereaksi dengan laju reaksi dalam hukum Aksi Massa sebagai berikut.
’’Laju reaksi dalam suatu sistem homogen pada suatu temperatur berbanding lurus dengan konsentrasi zat yang bereaksi, setelah masing-masing konsentrasi dipangkatkan dengan koefisiennya dalam persamaan reaksi yang bersangkutan”.

Tetapan jenis reaksi (k) merupakan suatu tetapan yang harganya bergantung pada suhu dan zat pereaksi. Dengan demikian, setiap reaksi mempunyai harga k yang berbeda-beda. Pada umumnya, reaksti yang berlangsung lambat mempunyai harga k kecil, sedangkan reaksi yang berlangsung cepat, mempunyai harga k besar.
Tingkat reaksi atau orde reaksi yaitu pangkat konsentrasi zat dalam rumus laju reaksi. Secara teoritis, tingkat reaksi pada reaksi kimia merupakan jumlah koefisien zat-zat yang bereaksi dalam persamaan reaksinya.
Rumus laju reaksi sebenarnya hanya dapat ditentukan secara eksperimen. Caranya dengan melakukan percobaan secara berulang-ulang terhadap zat yang akan ditentukan laju reaksinya. Pada percobaan ini, konsentrasi diubah-ubah dan waktu berlangsungnya reaksi dihitung.
Beberapa variabel yang digunakan dalam menentukan laju reaksi dengan cara eksperimen sebagai berikut.
- Variabel Bebas (Variabel Manipulasi)
Variabel bebas yaitu variabel yang sengaja diubah-ubah untuk memperoleh hubungan satu besaran dengan besaran lain. Misal konsentrasi dan suhu.
- Variabel Kontrol
Variabel kontrol yaitu variabel yang dipertahankan atau tidak diubah-ubah.
- Variabel Terikat (Variabel Respon)
Variabel terikat yaitu variabel yang berubah karena adanya perubahan variabel bebas. Misalnya laju reaksi yang berubah karena konsentrasi diubah.
Demikian penjelasan yang bisa kami sampaikan tentang Penjelasan Kemolaran Dan Pengertian Laju Reaksi Serta Persamaannya. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Pengertian, Rumus dan Contoh Soal Molaritas,… Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap – Kali ini kita aka membahas tentang pengertian dan rumus molaritas, pembuatan larutan dan pengenceran beserta dengan contoh soal dan…
- Laju Reaksi Apa Itu Laju Reaksi? Jadi laju reaksi itu adalah ya, laju dari sebuah reaksi. Bagaimana pengurangan suatu konsentrasi pereaksi atau penambahan konsentrasi. Satuannya adalah mol dm-3 atau M s-1 Pengurangan…
- “Molalitas & Fraksi Mol” Pengertian & ( Contoh – Rumus ) Untuk pembahasan kali ini kami akan mengulas mengenai molalitas dan fraksi mol yang dimana dalam hal ini meliputi pengertian, contoh dan rumus, supaya lebih jelas dan dapat dipahami kalau begitu…
- Pengertian Sel Elektrolisis, Kegunaan dan Contoh… Pengertian Sel Elektrolisis, Kegunaan atau manfaat dan Contoh Reaksi Sel Elektrolisis Terlengkap – Pada tahun 1989, terdapat dua ilmuwan mengumumkan bahwa mereka sudah mencapai “fusi dingin”, yaitu suatu proses fusi bersama…
- Pengertian Fotosintesis, Fungsi, Proses, Tahapan dan… Pengertian Fotosintesis, Fungsi, Proses, Tahapan dan Faktor Yang Mempengaruhi Fotosintesis Pada Tumbuhan Lengkap – Fotosintesis merupakan suatu proses biokimia pembentukan zat makanan yang dilakukan tumbuhan terutama tumbuhan yang mengandung klorofil atau…
- Apa Pengertian Senyawa Mungkin kalian bingung dengan pengertian dari senyawa dan molekul. Apakah senyawa dan molekul memiliki definisi yang berbeda atau sama? Baiklah kita sekarang akan bahas terlebih dahulu tentang senyawa. Senyawa adalah zat yang…
- PENYETARAAN REAKSI REDOKS Dua metode yang bisa digunakan adalah metode bilangan oksidasi dan setengah reaksi Metode bilangan oksidasi Langkah-langkah menyetarakan reaksi redoks dalam suasana asam Tentukan reaksi oksidasi dan reduksi dengan cara menuliskan perubahan…
- Karbon Monoksida: Pengertian, Struktur, Reaksi,… Dalam rumus kimia CO (karbon monoksida) merupakan gas yang tak berwarna, tak berasa, dan tak berbau. Ia terdiri dari satu atom yang kovelen yang berkaitana dengan satu atom oksigen. Dalam…
- Laju Reaksi : Pengertian, Rumus, Contoh Soal Dan… Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap Konsep pembelajaran kimia merupakan konsep yang erat dengan kehidupan sehari hari. Kimia menggambarkan kehidupan sedemikian rupa sehingga…
- Pengertian Teori Tumbukan dan Faktor-Faktor yang… Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna.…
- Makromolekul : Protein Kali ini kami akan membahas materi kimia tentang asam amino pada makromolekul. Protein Merupakan polimer alam yang tersusun dari asam-asam amino melalui ikatan peptida, sehingga protein juga disebut sebagai polipeptida.…
- Jenis Jenis Hubungan Kuantitatif Antara Pereaksi dan… Guldberg dan Waage mengemukakan hukum kesetimbangan dalam reaksi kesetimbangan kimia sebagai berikut. ”Dalam keadaan setimbang pada suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi hasil kali konsentrasi pereaksi yang ada dalam sistem kesetimbangan…
- Berbagai Cara Penentuan Perubahan Entalpi Reaksi Dan… Perubahan entalpi reaksi (ΔH) dapat ditentukan dengan berbagai cara, yaitu menggunakan kalorimeter, data entalpi pembentukan standar, diagram tingkat energi (hukum Hess), dan energi ikatan.Dibawah ini akan kita jelaskan secara rinci…
- Pengertian Dan Macam – Macam Larutan Penyangga Air liur merupakan pelindung alami bagi kesehatan gigi. Ketika terjadi sekresi dan kontak langsung dengan gigi, air liur akan menetralkan asam yang terbentuk dari proses fermentasi sisa makanan dimulut dan…
- Laju Reaksi Ada yang sudah mengenal atau pernah mendengar mengenai Laju Reaksi? Oke, mari simak penjelasan secara lengkapnya dibawah ini ya. Pengertian Laju Reaksi Laju Reaksi ialah sebuah laju penurunan ( reaktan atau…
- Hidrolisis Garam – Pengertian, Ciri-Ciri Dan Sifat… Hidrolisis berasal dari kata hidro artinya air dan lisis artinya penguraian. Jadi, hidrolisis adalah reaksi penguraian dalam air. Hidrolisis garam adalah reaksi penguraian garam dalam air membentuk ion positif dan…
- Asam Basa – Penentuan pH Asam Kuat Dan Basa Kuat… Setelah kita mempelajari tentang pH, pOH, dan pKw, dikatakan bahwa Istilah pH digunakan untuk menyatakan keasaman atau kebasaan suatu larutan. Istilah pH berasal dari potential of hydrogen yang dikemukakan oleh…
- Molaritas, Molalitas, Normalitas, Fraksi Mol Ada yang sudah mengenal atau pernah mendengar mengenai Molaritas, Molalitas, Normalitas, dan Fraksi Mol? 1. Mol Larutan (n) Mol merupakan massa (gram) pada suatu zat dibagi dengan massa molekul relatif atau berat…
- Hidrolisis Garam : Pengertian, Macam, Dan Rumus,… Karena pada kesempatan kali ini disini akan mengulas tentang pengertian Hidrolisis Garam, macam Hidrolisis Garam, dan rumus Hidrolisis Garam beserta contoh soalnya secara lengkap. Oleh karena itu marilah simak ulasan…
- Termokimia Jadi termokimia apa sih? kita bakal ngebahas tentang sistem dan lingkungan, yuk langsung saja! Perubahan Entalpi Entalpi sendiri itu delta H, jadi perubahan energi pada suatu zat Ada dua jenis:…