Gambar Tabel Periodik Unsur Kimia – Unsur kimia adalah zat kimia yang tidak dapat diubah lagi menjadi zat yang kecil atau dapat juga diartikan zat yang tidak dapat dibagi lagi jika menggunakan metode kimia yang biasa. Hingga saat ini dalam ilmu kimia ada sekitar 118 unsur di dunia ini yang bisa dilihat di gambar tabel periodik unsur kimia lengkap yang diakui secara internasional tapi tidak menutup kemungkinan jika nantinya ditemukan unsur kimia yang baru. Tapi sebenarnya apa yang dimaksud dengan tabel periodik unsur? Agar lebih memahaminya, kali ini kita akan membahas tentang pengertian tabel periodik, gambar HD, keterangan, cara membaca, unsur dan sifat sistem periodik.
Pengertian Tabel Periodik
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron, dan keberulangan sifat kimia. Tabel juga terbagi menjadi empat blok: blok -s, -p, -d, dan -f. Secara umum, dalam satu periode (baris), di sebelah kiri bersifat logam, dan di sebelah kanan bersifat non-logam. Baris pada tabel disebut periode, sedangkan kolom disebut golongan.
Ciri-Ciri Unsur Logam:
- Kerapatan pada unsurnya tinggi
- Unsur bersifat konduktor
- Padat (dapat dibentuk/ditempa)
Ciri-Ciri Unsur Non Logam:
- Kerapatan pada unsurnya rendah
- Unsur bersifat isolator
- Rapuh
Sistem periodik unsur adalah susunan unsur-unsur berdasarkan urutan nomor atom dan kemiripan sifat unsur tersebut. Dinamakan periodik, sebagaimana terdapat pola kemiripan sifat unsur dalam susunan tersebut. Sistem periodic unsure (tabel periodik) modern yang sekarang digunakan didasarkan pada tabel yang dipublikasikan oleh Dmitri Mendeleev pada tahun 1869.
Gambar Tabel Periodik
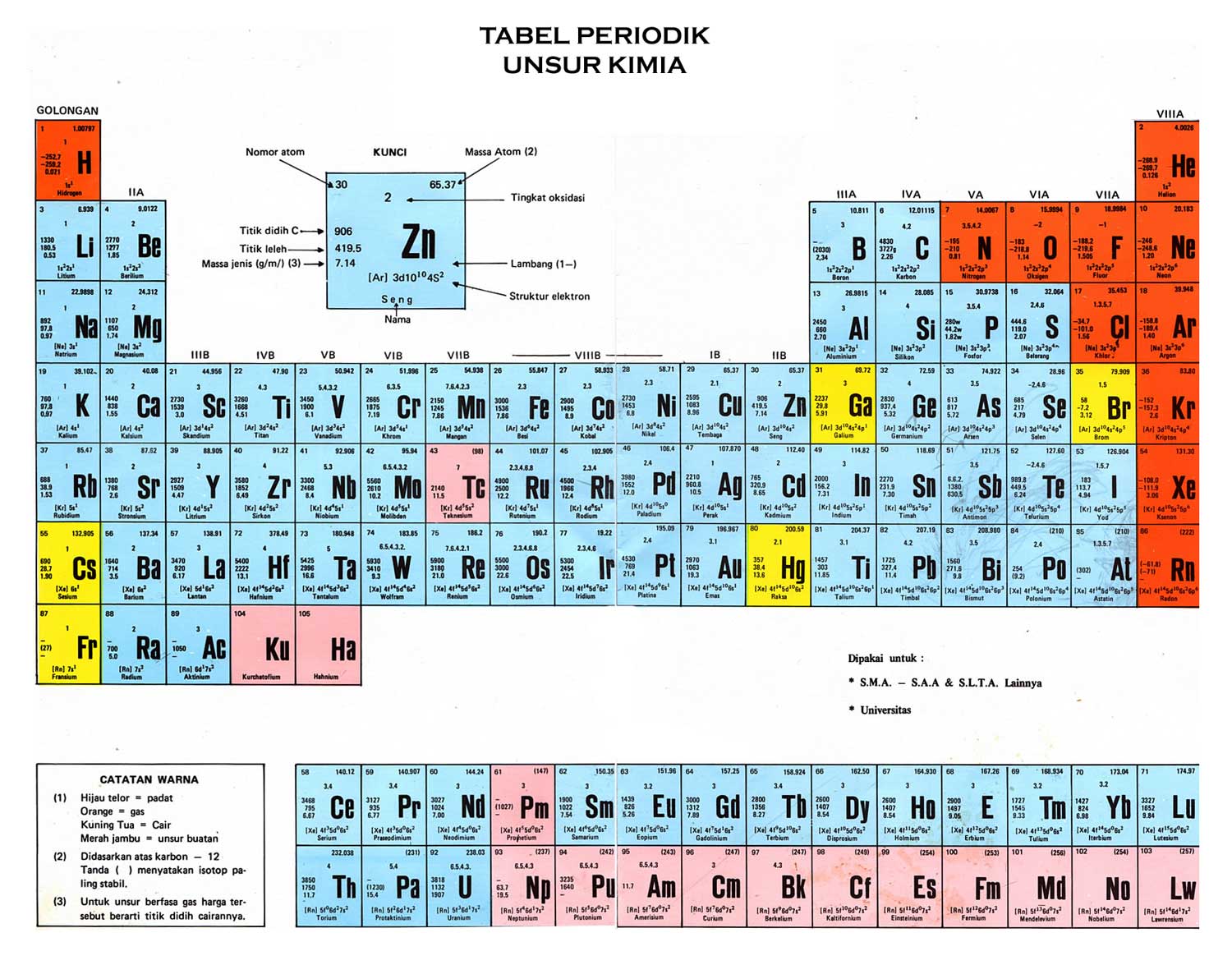
Keterangan atau format tabel periodik modern, meliputi:
- Masing-masing unsur terdapat pada satu kotak yang berisi nomor atom, nomor massa, dan lambang unsur. Kotak-kotak tersebut berurutan dari kiri ke kanan berdasarkan kenaikan nomor atom.
- Kotak tersebut tersusun membentuk barisan horizontal (periode) dan barisan vertikal (golongan). Setiap periode diberi nomor dari 1-7.
- Masing-masing golongan diberi nomor dari 1-8 dengan huruf A atau B.
Pada sistem IUPAC baru, masing-masing golongan diberi nomor dari 1 hingga 18 tanpa huruf A atau B. Unsur-unsur dalam satu golongan yang sama pada tabel periodik akan mempunyai kemiripan sifat. - Unsur-unsur golongan 1A-8A (golongan 1-2, 13-18) merupakan unsur golongan utama. Unsur-unsur golongan 1B-8B (golongan 3-12) merupakan unsur logam transisi. 2 deret unsur di bagian bawah, yaitu lanthanida dan aktinida, dinamakan unsur logam transisi dalam.
Keterangan Unsur Kimia Tabel Periodik
[table id=16 /]
Cara Membaca Tabel Periodik
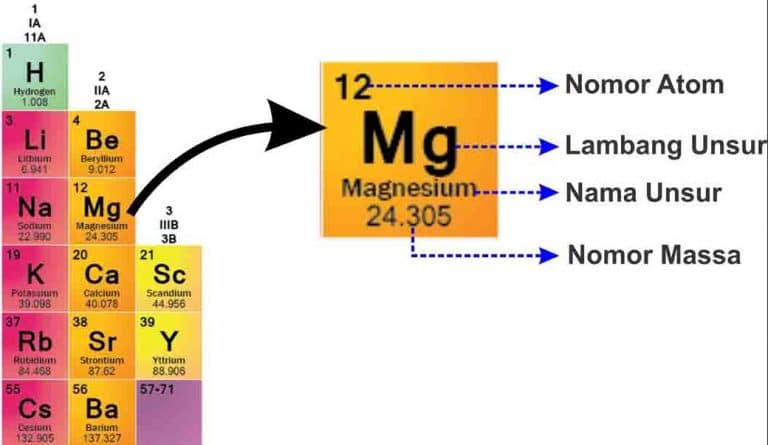
Penjelasannya Mg merupakan lambang dari unsur Magnesium (dapat lihat pada tabel keterangan yang telah dijabarkan diatas), dan pada unsur tersebut memiliki nomor atom 12 serta untuk nomor massanya ialah 24.035.
Unsur-Unsur Dalam Sistem Periodik
Golongan IA (Logam Alkali)
Untuk golongan IA semua logam nya tergolong logam yang lunak kira-kira sekeras karet penghapus, dan dapat di iris dengan pisau serta ringan massa jenisnya yaitu li, Na, dan K semuanya kurang dari 1 g/cm3.
Golongan IIA (Logam Akali Tanah)
Logam alkali tanah atau di singkat IIA tergolong logam yang aktif, tapi kereaktifan nya kurang jika di bandingakan dengan logam alkali seperiode, dan hanya akan bisa terbakar di udara bila dipanaskan, tapi terkecuali dengan berelium karna logam alkali tanah hanya larut dalam air. Dan di gunakan sebagai obat mag dalam kesehatan.
Golongan VIIA (Halogen)
Golongan dari VIIA merupakan kelompok unsur nonlogam yang sangat reaktif. Karna hal itu berkaitan dengan elektron valensi nya yang berjumlah 7, sehingga hanya memerlukan tambahan 1 elektron saja untuk mencapai konfigurasi stabil seperti contoh nya pada gas mulia.
Golongan VIIIA (Gas Mulia)
Unsur dari golongan VIIIA diantaranya Helium, Neon, Argon, Kripton, Xenon. Unsur ini sangat susah bereaksi dengan unsur yang lainnya dan di dalam nya tidak dapat di temukan satu pun senyawa alami dari unsur-unsur nya.
Golongan B (Unsur Transisi )
Unsur-unsur pada transisi adalah unsur-unsur yang terdapat di bagian tengah sistem periodik unsur yaitu unsur-unsur golongan tambahan (golongan B).
Seluruh unsur dari nomor atom 1 (hidrogen) hingga nomor atom 118 (oganesson) telah ditemukan, dengan penambahan terbaru (nihonium, moscovium, tennessine, dan oganesson) yang telah dikonfirmasi oleh International Union of Pure and Applied Chemistry (IUPAC) pada tanggal 30 Desember 2015 dan secara resmi telah diberi nama pada tanggal 28 November 2016, mereka menyelesaikan 7 baris pertama Tabel periodik.
94 unsur pertama ada secara alami, meski beberapa ditemukan dalam jumlah renik dan disintesis dalam laboratorium sebelum ditemukan di alam. Unsur-unsur mulai dari nomor atom 95 hingga 118 adalah unsur sintetis yang dibuat di laboratorium.
Bukti menunjukkan bahwa unsur dari nomor 95-100 ditemukan di alam, tapi saat ini tidak dijumpai lagi. Sintesis unsur dengan nomor atom yang lebih besar masih terus dikembangkan. Sejumlah radionuklida sintetis atau unsur yang berada di alam telah diproduksi di laboratorium.
Sifat-Sifat Pada Sistem Periodik Unsur
Sifat Logam
Berdasarkan sifatnya, unsur-unsur bisa dikelompokkan menjadi: logam, non logam, dan metalloid. Unsur-unsur logam mempunyai sifat-sifat: konduktor panas dan listrik yang baik, bisat ditempa dan ductile, titik leleh relatif tinggi, cenderung melepaskan elektron pada unsur non logam. Unsur-unsur non logam mempunyai sifat-sifat: nonkonduktor panas dan listrik, tidak bisa ditempa dan rapuh/getas, umumnya berwujud gas pada temperatur kamar, cenderung menerima elektron dari unsur logam. Unsur-unsur metalloid mempunyai sifat-sifat seperti logam dan juga non logam. Sifat logam semakin berkurang dari kiri ke kanan dan dari bawah ke atas sistem periodik unsur, kecuali hidrogen. Unsur-unsur metalloid berada pada [tangga] yang membatasi unsur-unsur logam dan non logam.
Baca Juga : Partikel Subatom Kimia
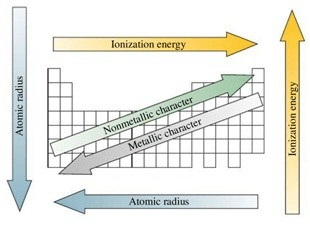
Jari-Jari Atom
Jari-jari atom ialah setengah dari jarak antara dua inti dari dua atom logam yang sejajar atau dalam sebuah molekul diatomik. Pada satu golongan, dari atas ke bawah jari-jari atom cenderung membesar, sebagaimana pertambahan kulit elektron. Dalam 1 periode, dari kiri ke kanan, jari-jari atom cenderung mengecil, sebagaimana pertambahan muatan inti efektif.
Energi Ionisasi
Energi ionisasi ialah energi yang dibutuhkan oleh sebuah atom atau ion dalam fase gas untuk melepaskan sebuah elektronnya. Pada satu golongan, dari atas ke bawah, energi ionisasi pertama cenderung mengecil, sebagaimana jarak dari inti ke elektron terluar bertambah sehingga tarikan elektron terluar oleh inti berkurang. pada satu periode, dari kiri ke kanan, energi ionisasi pertama cenderung membesar, sebagaimana pertambahan muatan inti efektif sehingga tarikan oleh inti bertambah.
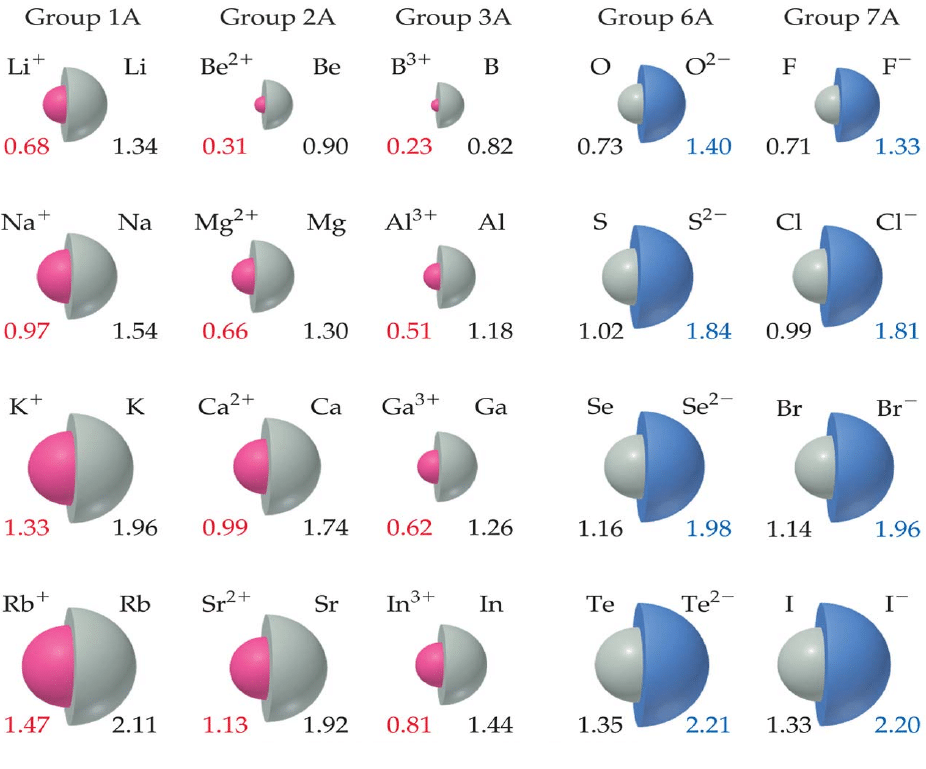
Jari-Jari Ion
Jari-jari ion yaitu jari-jari dari kation atau anion yang dihitung berdasarkan jarak antara dua inti kation dan anion pada kristal ionik. Kation (ion bermuatan positif) terbentuk dari pelepasan elektron dari kulit terluar atom netral maka tolakan antar elektron berkurang, tarikan elektron dari inti lebih kuat, dan jari-jari dari kation lebih kecil dari atom netralnya. Anion (ion bermuatan negatif) terbentuk dari penangkapan elektron pada atom netral maka tolakan antar elektron bertambah dan jari-jari dari anion lebih besar dari atom netralnya. Pada satu golongan pada sistem periodik unsur, dari atas ke bawah, jari-jari ion bermuatan sama cenderung memebesar, sebagaimana pertambahan kulit elektron. Dalam periode, pada deretan ion iso elektronik (spesi-spesi dengan jumlah elektron sama dan konfigurasi elektronnya sama, seperti O2-, F-, Na+, Mg2+, dan Al3+ dg 10 elektron), semakin besar muatan kation jadi semakin kecil jari-jari ion, tetapi semakin besar muatan anion jadi semakin besar jari-jari ion.
Baca Juga : Penggolongan Materi Kimia
Afinitas Elektron
Afinitas elektron ialah kuantitas perubahan energi ketika sebuah atom / ion dalam fase gas menerima sebuah elektron. apabila kuantitas perubahan energi bertanda positif, makan terjadi penyerapan energi, namun, jika bertanda negatif, terjadi pelepasan energi. Semakin negatif nilai afinitas elektron, semakin besar kecenderungan atom atau ion menerima elektronnya (afinitas terhadap elektron semakin besar). Pada satu golongan pada tabel periodik unsur, dari atas ke bawah, afinitas elektron cenderung mengecil, dengan banyak pengecualian. Pada satu periode, dari kiri ke kanan, sampai golongan 7A, afinitas elektron cenderung membesar, dengan banyak pengecualian.
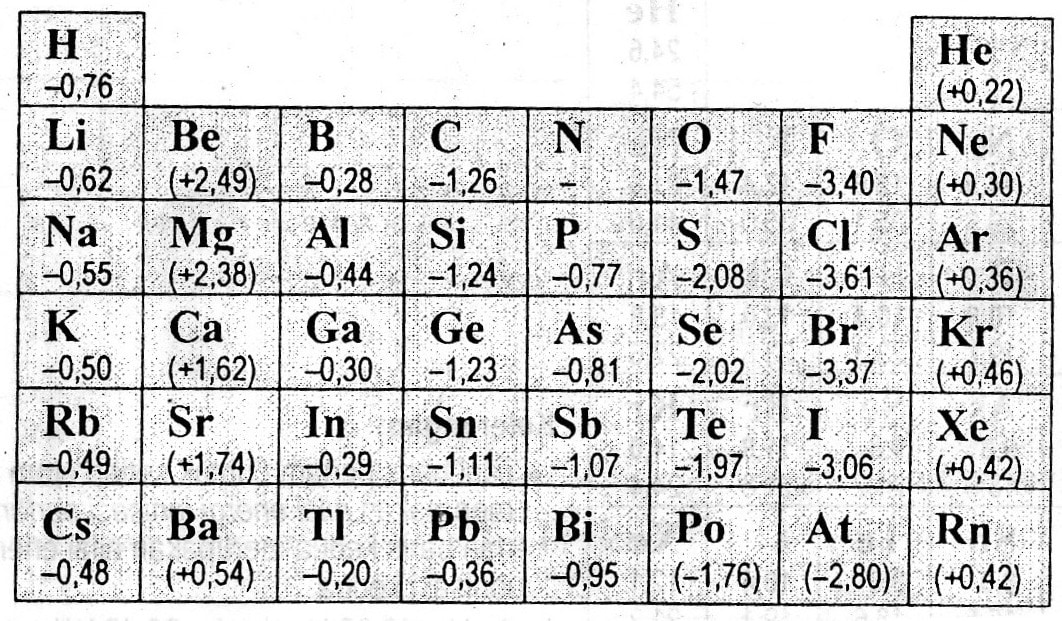
Elektronegativitas
Elektronegativitas adalah ukuran kemampuan suatu atom pada sebuah molekul (keadaan berikatan) untuk menarik elektron kepadanya. Semakin besar elektronegativitas, maka semakin mudah atom tersebut menarik elektron kepadanya sendiri. Pada satu golongan, dari atas ke bawah, elektronegativitas cenderung mengecil. Dalam satu periode, dari kiri ke kanan, elektronegativitas cenderung membesar.
Baca Juga : Sejarah Perkembangan Ilmu Kimia
Demikian pembahasan tentang tabel periodik unsur kimia, mulai dari pengertian tabel periodik, gambar HD, keterangan, cara membaca, unsur dan sifat sistem periodik.