Asas Larangan Pauli – Pengertian Orbital Atom , Konfigurasi Elektron Atom Berelektron Banyak, Dan Sistem Periodik Unsur
Wolfgang Pauli menemukan asas yang mengatur konfigurasi atom-atom berelektron banyak. Asas Larangan Pauli berbunyi:
” Tidak mungkin terdapat dua elektron dalam sebuah atom yang berada dalam keadaan kuantum yang sama”.
Ini berarti elektron.-elektron dalam sebuah atom tidak mungkin memiliki keempat bilangan kuantum ( n, ℓ, m , s ) yang tepat sama, melainkan sedikitnya satu bilangan kuantum harus berbeda.
Pengertian kulit, sub kulit, dan orbital atom
Tempat kedudukan-tempat kedudukan di mana elektron-elektron memiliki energi total yang sama besar disebut kulit atom (shell). Kulit diberi label huruf besar mulai dari K dan selanjutnya sesuai urutan abjad. Kulit K menyatakan keadaan n-1, kulit L menyatakan keadaan n = 2, dan seterusnya seperti ditunjukkan pada tabel berikut ini:
| Nama Kulit |
K L M N O … … |
| Bilangan kuantum utama |
1 2 3 4 5 … …. |
Suatu kulit terdiri dari beberapa sub kulit (sub shell). Sub kulit diberi label huruf kecil s,p,d,f,g,h,i…. Sub kulit s menyatakan keadaan ℓ = 0, sub kulit p untuk ℓ = 1, dan seterusnya seperti ditunjukkan pada tabel berikut ini:
| Nama Sub Kulit |
S p d f g h … … |
| Bilangan kuantum orbital ℓ |
0 1 2 3 4 5 … … |
Suatu sub kulit terdiri dari beberapa orbital. Banyak orbital dari suatu sub kulit berhubungan dengan banyak nilai mℓ yang diperbolehkan untuk sub kulit itu. Ternyata banyak orbital dimulai dari sub kulit s dan seterusnya sesuai dengan barisan angka-angka 1,3,5,7 …. dan seterusnya seperti ditunjukkan pada tabel di bawah ini:
| Nama sub kulit |
S p d f g h … …. |
| Banyak orbital |
1 3 5 7 9 11 … …. |
Suatu orbital ditempati oleh maksimum dua elektron dengan spin berlawanan arah (s = +14 dan s = -14).
Konfigurasi elektron atom berelektron banyak
Ada empat aturan yang diperlukan untuk membuat konfigurasi elektron atom-atom berelektron banyak, yaitu:
- Wolfgang Pauli menyatakan bahwa setiap orbital hanya mampu menampung maksimum dua elektron dan dua elektron dalam satu orbital selalu memiliki spin dengan arah berlawanan.
- Prinsip Aufbau: elektron dalam suatu atom berusaha menempati sub kulit-sub kulit berenergi rendah terlebih dahulu. Urut-urutan pengisian elektron dapat dilakukan dengan pertolongan diagram berikut:
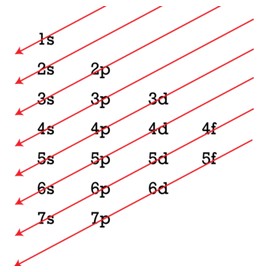
- Aturan Hund: elektron-elektron dalam orbital suatu sub kulitcenderung tidak berpasangan. Elektron- elektron baru berpasangan apabila semua orbital dalam suatu sub kulit telah penuh diisi dengan spin sejajar
- Azas Pauli: tidak mungkin terdapat dua elektron dalam suatu atom yang memiliki keempat bilangan kuantum tepat sama.
Sistem periodik unsur
Sistem periodik unsur memperlihatkan unsur-unsuryang memiliki sifat kimia dan fisika sama disusun dalam kolom vertikal yang disebut golongan. Penyusunan sistem periodik didasarkan pada keempat aturan dasar yang telah kita bahas sebelumnya. Ternyata sifat kimia dan fisika unsur-unsur hanya di pengaruhi oleh elektron-elektron yang mengisi sub kulit terluar. Golongan utama (atau golongan A) adalah unsur-unsur dengan sub kulit terluar s atau p. Golongan transisi (atau golongan B) adalah unsur-unsur dengan sub kulit ‘terdalam’ (n -1) d terisi kemudian setelah sub kulit ‘terluar’s. Lantanida (unsur tanah- langka) adalah unsur-unsur dengan sub kulit terdaiam 4f terisi kemudian setelah sub kulit ‘terluar’ 6s. Karena sub kulit f dengan 7 orbital diisi maksimum 14 elektron, maka Lantanida hanya terdiri dari 14 unsur.
Dengan memperhatikan konfigurasi elektron unsur-unsur yang disusun dalam satu golongan, kita bisa memperkirakan sifat-sifat kimia dan fisika unsur-unsur tersebut.
Demikian penjelasan yang bisa kami sampaikan tentang Asas Larangan Pauli – Orbital Atom , Konfigurasi Elektron, Dan Sistem Periodik Unsur. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Unsur Cl bernomor atom 17 yang memiliki golongan dan… Unsur Cl bernomor atom 17 yang memiliki golongan dan periode berturut-turut adalah . . . . A. VIIB dan 3 B. VIA dan 3 C. VIIA dan 3 D. IIB…
- Dari unsur di bawah, memiliki konfigurasi elektron :… Dari unsur di bawah, memiliki konfigurasi elektron : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶ (1) Memiliki nomor atom 26 (2) Memiliki 2 elektron tak berpasangan (3) Terletak pada periode…
- Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi… Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi Asam Basa Terlengkap – Tentu saja kita sering mendengar istilah asam basa dalam kimia. Kata asam berasal dari bahasa Latin acidu” yang berarti…
- Tabel Periodik Unsur Kimia adalah suatu susunan unsur-unsur berdasarkan urutan nomor atom dan kemiripan sifat unsur tersebut. Dinamakan periodik, sebagaimana terdapat pola kemiripan pada sifat unsur dalam susunan tersebut. Sistem periodic unsure (tabel periodik)…
- Aturan Penulisan Rumus Kimia dan Nama Senyawa Sederhana Suatu senyawa sederhana dapat disusun oleh unsur logam dan unsur nonlogam atau unsur nonlogam dengan nonlogam. Aturan penamaan senyawa dipengaruhi oleh jenis unsur yang membentuknya. Oleh karena itu, aturan penamaan senyawa terbagi…
- Makalah Ikatan Kimia : Pengertian, Jenis Beserta… Sistem periodik kimia adalah tampilan unsur-unsur kimia yang tertera dalam tabel. Jumlah unsur yang terdapat pada tabel sistem periodik adalah sebanyak 118 unsur. Jumlah unsur yang terdapat di alam lebih…
- Pengertian, Cara Menentukan, Contoh Soal Rumus… Pengertian, Cara Menentukan, Contoh Soal Rumus Empiris dan Rumus Molekul Senyawa Lengkap – Rumus kimia merupakan salah satu ciri khas dari senyawa kimia. Rumus kimia terbagi menjadi 2 (dua) yaitu rumus…
- Atom-atom dibawah ini yang paling lemah menarik… Atom-atom dibawah ini yang paling lemah menarik elektron adalah yang memiliki nomor atom . . . . A. 16 B. 13 C. 9 D. 7 E. 17 Jawaban : D.…
- Rangkuman Materi Metabolisme dan Contoh Latihan Soal Lengkap Rangkuman Materi Metabolisme dan Contoh Latihan Soal Lengkap Bertemu lagi dengan postingan-postingan mengenai materi pelajaran sekolah, kali ini ini akan membahas rangkuman dari materi yang telah kita pelajari pada artikel…
- Pemerintah Daerah Kali ini akan membahas mengenai Pemerintah Daerah. Ada yang sudah mengenal atau pernah mendengar mengenai istilah Pemerintah Daerah? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Pemerintah Daerah Pemerintahan Daerah merupakan…
- Unsur, Senyawa dan Campuran Setiap hari kita sering menjumpai benda-benda yang mempunyai suatu bentuk, sifat, dan struktur penyusunnya yang beda-beda. Benda-benda tersebut ada yang dibentuk dari gabungan beberapa benda dan ada pula yang tidak…
- Konfigurasi elektron yang memiliki golongan IIA dan… Konfigurasi elektron yang memiliki golongan IIA dan periode 3 adalah . . . . A. 1s² 2s² 2p⁶ B. 1s² 2s² 2p⁶ 3s² 3p⁶ C. 1s² 2s² 2p⁶ 3s² D.…
- Karbon Monoksida: Pengertian, Struktur, Reaksi,… Dalam rumus kimia CO (karbon monoksida) merupakan gas yang tak berwarna, tak berasa, dan tak berbau. Ia terdiri dari satu atom yang kovelen yang berkaitana dengan satu atom oksigen. Dalam…
- Ikatan Kovalen ahukah anda apa yang dimaksud dengan ikatan kovalen ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada kesempatan kali ini akan membahas tentang pengertian ikatan kovalen, jenis-jenis…
- Unsur Ne memiliki golongan VIIIA dan periode 2, maka… Unsur Ne memiliki golongan VIIIA dan periode 2, maka nomor atom Ne adalah . . . . A. 8 B. 10 C. 12 D. 14 E. 16 Jawaban : B.…
- Materi Atom Di dalam alam jagad raya ini terdapat beberapa partikel penyusun dari suatu unsur yang tidak bisa kita lihat dan kita rasakan kehadirannnya namun memang ada. Di dalam menyusun suatu unsur…
- Yang merupakan penyusun sistem periodik yang… Yang merupakan penyusun sistem periodik yang menggunakan kenaikan nomor atom adalah . . . . A. Oktav Newland B. Trade Dobereiner C. Sistem Periodik Panjang D. Lothar Meyer E. Mendeleev…
- Penggolongan Materi: Pengertian Zat Tunggal ,… Materi didefinisikan sebagai segala sesuatu yang menempati ruang dan mempunyai massa. Materi tersebut amat banyak ragamnya. Amatilah benda-benda di sekitarmu, mungkin Anda dapat menyebutkan ratusan jenis materi. Seperti air, batu,…
- Pengertian Dan Bagian-Bagian Partikel Subatom Kimia… Pengertian Dan Bagian-Bagian Partikel Subatom Kimia Terlengkap – Partikel subatom atau zarah adalah partikel yang bentuknya lebih kecil daripada atom. Kira-kira pada tahun 1940, jumlah partikel subatomik yang dikenal dengan ilmu…
- Program yang membantu mengatur konfigurasi komputer… Program yang membantu mengatur konfigurasi komputer dan menjaga komputer dari hacker dan virus serta menyelamatkan data disebut... A. Linux B. Ubuntu C. Sistem operasi D. Sistem informasi E. Utility Jawaban…
