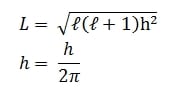Setelah kita bahas tentang perkembangan teori atom, disebutkan bahwa teori atom mengalami perkembangan yang pesat, dari hasil percobaan menunjukkan bahwa atom masih terdiri dari partikel – partikel yang lebih kecil yaitu proton, neutron dan elektron. kali ini kita bahas mengenai atom berelektron banyak.
Model atom Bohr dapat menjelaskan kestabilan atom dan spektrum garis atom hidrogen (deret Lyman, Balmer, Paschen, Bracket dan Pfund). Dalam penyelidikan selanjutnya, model atom Bohr tidak dapat menjelaskan:
- Efek Zeeman, yaitu gejala tambahan garis – garis spektrum jika atom – atom tereksitasi diletakkan dalam medan magnet.
- Spektrum dari atom – atom berelektron banyak.
Elektron – elektron yang bergerak dalam orbitnya mempertunjukkan sifat gelombang (teori de Broglie) sehingga orbit pasti elektron tidak dapat didefinisikan secara tepat melainkan hanya kebolehjadian menemukan elektron. Dengan demikian model atom Bohr digantikan dengan model atom baru, yakni disebut model atom mekanika kuantum. Setiap elektron dapat digolongkan berdasarkan empat bilangan kuantum yang akan diuraikan berikut ini.
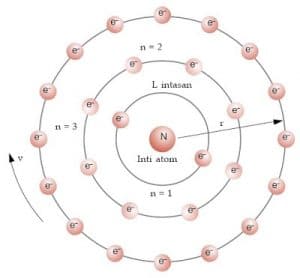
Bilangan Kuantum Utama (n)
Bilangan kuantum utama (lambang n) sesuai dengan bilangan n yang digunakan oleh Bohr untuk menentukan energi total elektron. Energi total elektron bertanda negatif, yang berarti bahwa untuk mengeluarkan elektron sehingga bebas dari grbitnya diperlukan energi. Energi total elektron terkuantisasi artinya hanya dapat memiliki harga tertentu/diskret. Perhatikan, energi total elektron hanya bergantung pada n dan tidak pada bilangan-bilangan kuantum lainnya. Untuk atom hidrogen, energi total elektron dinyatakan oleh:
Nilai-nilai bilangan kuantum utama adalah bilangan bulat mulai dari 1 sampai tak hingga.
Bilangan kuantum utama (n) = 1,2, 3
Bilangan kuantum utama membatasi jumlah elektron yang dapat menempati suatu orbit
Jumlah elektron maksimum pada orbit ke – n = 2n2
Pada gejala efek Zeeman, Pieter Zeeman menemukan garis-garis tambahan dalam spektrum emisi jika atom-atom yang tereksitasi diletakkan dalam medan magnet. Efek Zeeman tidak dapat dijelaskan dengan orbit lingkaran Bohr karena orbit lingkaran Bohr hanya memiliki satu orientasi atom atau satu vektor momentum sudut.
Bilangan Kuantum Orbital (ℓ)
Berdasarkan efek Zeeman, Arnold Sommerfeld (1868-1951) mengusulkan orbit elips selain orbit lingkaran (orbit lingkaran adalah khusus dari orbit elips). Dengan orbit elips maka orientasi orbit dapat lebih dari satu, sehingga untuk menyatakan keadaan elektron diperlukan dua bilangan kuantum lain yang menyatakan vektor orbital (bilangan kuantum momentum sudut) dan bilangan kuantum magnetik. Bilangan kuantum orbital (diberi lambang ℓ) adalah bilangan kuantum yang menentukan besar momentum sudut elektron (L). Nilai l dibatasi oleh nilai n, yaitu bilangan bulat mulai dari 0 sampai (n-1)
Bilangan kuantum orbital (ℓ) = 0,1,2,3,…. ( n-1)
Misalnya untuk n = 3, nilai bilangan kuantum orbital yang diperbolehkan adalah ℓ= 0,1 dan 2. Hubungan antara ℓ dan besar momentum sudut L dinyatakan oleh:
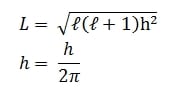
h = tetapan Planck = 6,63 . 10-34 J.s
Bilangan Kuantum Magnetik (m)
Momentum sudut adalah suatu besaran vektor sehingga arahnyajuga harus ditentukan. Bilangan kuantum magnetik (diberi lambang mℓ), menunjukkan arah dari momentum sudut orbital L. Nilai mℓ adalah bilangan bulat mulai dari -1 sampai +1.
Bilangan kuantum magnetik (mℓ) = -ℓ1, …. 0, …+ ℓn
Misalnya untuk ℓ = 1, nilai bilangan kuantum magnetik yang diperbolehkan adalah mℓ= -1,0, dan +1.
Bilangan Kuantum Spin (s)
Bilangan kuantum spin (s) menentukan arah perputaran elektron pada porosnya, nilai s = + ½ dan – ½ .
Tabel dibawah ini merupakan tabel rangkuman keempat bilangan kuantum.
| Nama |
Lambang |
Nilai yang diperbolehkan |
| Bilangan kuantum utama |
n |
1, 2, 3, … |
| Bilangan kuantum orbital |
ℓ |
0, 1, 2, 3… … (n-1) |
| Bilangan kuantum magnetic |
mℓ |
-ℓ, …, …, -2, -1, 0, +1, +2 , …,… +ℓ |
| Bilangan kuantum spin |
S |
– ½ , + ½ |
Demikian penjelasan yang bisa kami sampaikan tentang Atom Berelektron Banyak – Bilangan Kuantum Utama, Orbital, Magnetik dan Kuantum Spin. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Rangkuman Materi Metabolisme dan Contoh Latihan Soal Lengkap Rangkuman Materi Metabolisme dan Contoh Latihan Soal Lengkap Bertemu lagi dengan postingan-postingan mengenai materi pelajaran sekolah, kali ini ini akan membahas rangkuman dari materi yang telah kita pelajari pada artikel…
- Pengertian, Sifat Dan Macam-Macam Medan Magnet Serta… Pengertian, Sifat Dan Macam-Macam Medan Magnet Serta Penjelasannya Lengkap – Pada dua batang magnet yang didekatkan, maka akan terjadi suatu gaya tarik-menarik / tolak menolak antara kedua magnet tersebut. Gaya…
- Senyawa – Ciri, Sifat, Pengertian, Macam, Perbedaan,… Senyawa – Ciri, Sifat, Pengertian, Macam, Perbedaan, Rumus, Singkatan, Peranan : Senyawa adalah suatu zat tunggal yang masih bisa diuaraikan menjadi dua unsur atau lebih. Senyawa mempunyai beberapa unsur yang saling…
- Pengertian DNA dan RNA, Fungsi, Struktur dan… Pengertian DNA dan RNA, Fungsi, Struktur dan Jenisnya Terlengkap – Kali ini kita akan membahas tentang DNA (Deoxyribonucleic acid) dan RNA (Ribonucleic acid), serta fungsi, struktur atau komponen penyusun dan jenisnya lengkap.…
- Unsur-Unsur Radioaktif Kali ini kami akan membahas tentang unsur-unsur radioaktif pelajaran kimia. Yuk, kita pelajari bersama-sama. Jenis Sinar Radioaktif Unsur radioaktif ialah unsur yang mempunyai inti atom tidak stabil dan bisa memancarkan sinar alfa, sinar…
- Materi Atom Di dalam alam jagad raya ini terdapat beberapa partikel penyusun dari suatu unsur yang tidak bisa kita lihat dan kita rasakan kehadirannnya namun memang ada. Di dalam menyusun suatu unsur…
- Tabel Periodik Unsur Kimia : Pengertian, Gambar dan… Gambar Tabel Periodik Unsur Kimia – Unsur kimia adalah zat kimia yang tidak dapat diubah lagi menjadi zat yang kecil atau dapat juga diartikan zat yang tidak dapat dibagi lagi jika…
- Dari unsur di bawah, memiliki konfigurasi elektron :… Dari unsur di bawah, memiliki konfigurasi elektron : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶ (1) Memiliki nomor atom 26 (2) Memiliki 2 elektron tak berpasangan (3) Terletak pada periode…
- Pengertian, Fungsi, Tahapan dan Hasil Siklus Krebs… Pengertian, Fungsi, Tahapan dan Hasil Siklus Krebs Terlengkap – Siklus asam sitrat atau siklus asam trikarboksilat atau disebut juga dengan siklus Krebs merupakan tahapan kedua dari respirasi aerob. Sesuai dengan…
- Pengertian Sorbitol dan Apa Dampak yang Ditimbulkan? pengertian sorbitol adalah sebuah gula alkohol dengan 4 kalori per gram. Nama “sorbitol” berasal dari Sorbus, nama ilmiah untuk sejenis genus dari tumbuh-tumbuhan. Tumbuhan-tumbuhan bergenus sorbus inilah yang menghasilkan sorbitol. Tumbuhan lain…
- Berbagai Cara Penentuan Perubahan Entalpi Reaksi Dan… Perubahan entalpi reaksi (ΔH) dapat ditentukan dengan berbagai cara, yaitu menggunakan kalorimeter, data entalpi pembentukan standar, diagram tingkat energi (hukum Hess), dan energi ikatan.Dibawah ini akan kita jelaskan secara rinci…
- Pengertian Sistem Periodik Unsur dan Sifat-Sifat… Pengertian Sistem Periodik Unsur (SPU) dan Sifat-Sifat Pada Tabel Periodik Unsur Kimia Terlengkap – Sistem periodik unsur adalah susunan unsur-unsur berdasarkan urutan nomor atom dan kemiripan sifat unsur tersebut. Dinamakan periodik, sebagaimana terdapat…
- Penjelasan Ruang Lingkup Ilmu Kimia Terlengkap Ilmu yang mempelajari alam semesta disebut ilmu pengetahuan alam (,natural science = IPA). Ilmu kimia merupakan salah satu di antara ilmu-ilmu IPA. Ilmu pengetahuan alam sudah diajarkan sejak di Sekolah…
- Asas Larangan Pauli – Orbital Atom , Konfigurasi… Asas Larangan Pauli – Pengertian Orbital Atom , Konfigurasi Elektron Atom Berelektron Banyak, Dan Sistem Periodik Unsur Wolfgang Pauli menemukan asas yang mengatur konfigurasi atom-atom berelektron banyak. Asas Larangan Pauli…
- Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi… Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi Asam Basa Terlengkap – Tentu saja kita sering mendengar istilah asam basa dalam kimia. Kata asam berasal dari bahasa Latin acidu” yang berarti…
- Makalah Ikatan Kimia : Pengertian, Jenis Beserta… Sistem periodik kimia adalah tampilan unsur-unsur kimia yang tertera dalam tabel. Jumlah unsur yang terdapat pada tabel sistem periodik adalah sebanyak 118 unsur. Jumlah unsur yang terdapat di alam lebih…
- Ikatan Kovalen ahukah anda apa yang dimaksud dengan ikatan kovalen ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada kesempatan kali ini akan membahas tentang pengertian ikatan kovalen, jenis-jenis…
- Ikatan Ion : Pengertian, Ciri, Dan Syarat… Ikatan Ion : Pengertian, Ciri, Dan Syarat Terjadinya, Beserta Contohnya Lengkap – Tahukah anda apa yang dimaksud dengan ikatan ion ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada…
- Pada sistem periodik unsur modern, golongan… Pada sistem periodik unsur modern, golongan menyatakan jumlah . . . . A. Elektron B. Proton valensi C. Neutron D. Subkulit atom E. Elektron valensi Jawaban : A. Elektron
- Mempelajari Sejarah Perkembangan Ilmu Kimia Terlengkap Sekitar tahun 3500 SM, peradaban Mesir kuno sudah mempraktikan reaksi kimia. Pada masa itu telah diketahui cara membuat anggur, pengawetan mayat, dan pengolahan beberapa logam seperti tembaga dan timah Sekitar…