Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna. Tumbukan sempurna dinamakan tumbukan efektif. Partikel zat yang saling bertumbukan kadang-kadang juga tidak langsung berubah menjadi zat hasil. Tumbukan tersebut terlebih dahulu membentuk suatu molekul kompleks yang disebut molekul kompleks teraktivasi. Pembentukan molekul kompleks teraktivasi berhubungan dengan energi aktivasi. Energi aktivasi (EA) merupakan energi tumbukan terendah yang diperlukan untuk pembentukan molekul kompleks teraktivasi sehingga reaksi dapat berlangsung.
Tumbukan yang menghasilkan reaksi adalah tumbukan yang antar partikelnya mempunyai energi lebih besar daripada energi aktivasi. Semakin kecil harga energi aktivasi, semakin cepat reaksi berlangsung.
Reaksi P + Q → R + S dapat terjadi jika P + Q memiliki energi aktivasi minimum. Adanya energi aktivasi minimum memungkinkan terjadinya tumbukan yang menghasilkan energi, dengan syarat energi tumbukan pereaksi > Ea.
Teori tumbukan
Teori tumbukan yang didasarkan atas teori kinetik molekul gas menyatakan beberapa hal berikut.
- Gas terdiri atas molekul-molekul gas yang berukuran lebih kecil daripada jarak antarmolekul.
- Molekul-molekul gas selalu bergerak lurus ke segala arah.
- Tumbukan antara molekul-molekul gas dengan dinding wadahnya bersifat elastis sempurna, artinya molekul-molekul gas akan dipantulkan kembali tanpa kehilangan energi.
- Kecepatan gerak molekul gas dipengaruhi oleh perubahan suhu. Semakin tinggi suhu, maka semakin cepat gerak molekul-molekul gas.
- Energi kinetik rata-rata molekul gas sama besar pada suhu yang sama atau tidak dipengaruhi oleh massanya.
Besarnya laju reaksi dari suatu reaksi kimia dipengaruhi oleh beberapa faktor. Kita dapat mengatur besarnya laju reaksi dengan cara mengubah faktor-faktor yang memengaruhi laju reaksi. Namun, perlu diingat bahwa untuk data sebuah percobaan dengan variasi beberapa faktor, tidak semua faktor selalu berpengaruh.
Faktor-Faktor yang Memengaruhi Laju Reaksi
a. Konsentrasi
Konsentrasi berhubungan dengan frekuensi tumbukan. Semakin besar konsentrasi, maka semakin banyak partikel zatyang bereaksi. Akibatnya, kemungkinan tumbukan antarpartikel pereaksi semakin besar dan tumbukan efektif antarpartikel juga semakin banyak. Dengan demikian, reaksi akan semakin cepat berlangsung.
b. Luas Permukaan
Jika luas permukaan semakin besar, kemungkinan terjadi singgungan antarpereaksi juga akan semakin besar. Hal ini akan memperbanyak frekuensi tumbukan sehingga tumbukan efektif juga akan banyak terjadi. Frekuensi tumbukan efektif yang semakin banyak akan meningkatkan laju reaksi.
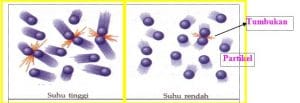
c. Suhu
Ketika suhu dinaikkan, energi kinetik dalam molekul reaktan juga bertambah. Adanya energi kinetik yang tinggi mengakibatkan gerakan antarmolekul semakin cepat dan acak. Akibatnya, frekuensi tumbukan yang terjadi semakin besar, dan tumbukan efektif juga akan semakin banyak sehingga reaksi semakin cepat berlangsung.
d. Katalis
Katalis yaitu zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimia secara kekal atau permanen sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Katalis dibedakan menjadi dua, yaitu katalis homogen dan katalis heterogen.
Katalis homogen yaitu katalis yang mempunyai fase sama dengan fase pereaksi. sedangkan, Katalis heterogen yaitu katalis yang mempunyai fase berbeda dengan fase pereaksi. Pada umumnya katalis heterogen digunakan dalam wujud padat. Sementara itu, reaktannya berwujud gas.
Penambahan katalis mengakibatkan terbentuknya tahap-tahap reaksi tambahan yang memberikan jalan lain dengan energi aktivasi (Ea) lebih rendah. Energi aktivasi (Ea) yaitu energi minimal yang harus dimiliki atau diberikan kepada partikel agartumbukannya menghasilkan reaksi. Tahap-tahap reaksi tambahan berupa tahap pengikatan katalis dan tahap pelepasan katalis pada akhir reaksi. Katalis bersifat spesifik, yaitu hanya dapat berfungsi untuk suatu reaksi tertentu.
Katalis berfungsi untuk menurunkan energi aktivasi. Adanya katalis akan mengakibatkan reaksi berlangsung dalam beberapa tahap. Rangkaian tahap-tahap reaksi dalam suatu reaksi kimia disebut mekanisme reaksi. Tahap reaksi paling lambat dalam suatu mekanisme reaksi merupakan tahap penentu laju reaksi.
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian Teori Tumbukan dan Faktor-Faktor yang Mempengaruhi Laju Reaksi. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Laju Reaksi : Pengertian, Rumus, Contoh Soal Dan… Laju Reaksi : Pengertian, Faktor Yang Mempengaruhi, Dan Rumus Beserta Contoh Soalnya Lengkap Konsep pembelajaran kimia merupakan konsep yang erat dengan kehidupan sehari hari. Kimia menggambarkan kehidupan sedemikian rupa sehingga…
- Materi Stoikiometri Ada yang sudah mengenal atau pernah mendengar mengenai Stoikiometri? Oke, mari simak penjelasan secara lengkapnya dibawah ini ya. Pengertian Stoikiometri Kata “Stoikiometri” ini berasal dari bahasa Yunani, yaitu dari kata “Stoicheion” yang berarti “unsur” dan juga…
- Glukosa Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Glukosa? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Glukosa Glukosa sering disebut juga dengan dekstrosa , d-glukosa ataupun gula buah. Glukosa…
- Pengertian, Susunan, Bagian, Lapisan, Spektrum dan… Pengertian Matahari , Susunan, Struktur Bagian, Lapisan, Spektrum dan Manfaat Matahari Bagi Kehidupan Terlengkap – Matahari adalah bintang yang mempunyai massa yang sangat besar. Karena gravitasinya, matahari menjadi pusat tata surya. Meskipun bukan…
- Karbon Monoksida: Pengertian, Struktur, Reaksi,… Dalam rumus kimia CO (karbon monoksida) merupakan gas yang tak berwarna, tak berasa, dan tak berbau. Ia terdiri dari satu atom yang kovelen yang berkaitana dengan satu atom oksigen. Dalam…
- Jenis Jenis Hubungan Kuantitatif Antara Pereaksi dan… Guldberg dan Waage mengemukakan hukum kesetimbangan dalam reaksi kesetimbangan kimia sebagai berikut. ”Dalam keadaan setimbang pada suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi hasil kali konsentrasi pereaksi yang ada dalam sistem kesetimbangan…
- Pengertian, Fungsi, Tahapan dan Hasil Siklus Krebs… Pengertian, Fungsi, Tahapan dan Hasil Siklus Krebs Terlengkap – Siklus asam sitrat atau siklus asam trikarboksilat atau disebut juga dengan siklus Krebs merupakan tahapan kedua dari respirasi aerob. Sesuai dengan…
- Berbagai Bentuk Molekul, Pengertian Teori Domain… Setiap molekul yang tersusun dari atom unsur tertentu dengan jumlah yang tertentu pula akan mempunyai bentuk molekul tertentu. Bentuk molekul merupakan bentuk geometris yang terjadi jika inti atom unsur yang…
- Pengertian Fotosintesis, Fungsi, Proses, Tahapan dan… Pengertian Fotosintesis, Fungsi, Proses, Tahapan dan Faktor Yang Mempengaruhi Fotosintesis Pada Tumbuhan Lengkap – Fotosintesis merupakan suatu proses biokimia pembentukan zat makanan yang dilakukan tumbuhan terutama tumbuhan yang mengandung klorofil atau…
- Apa Pengertian Senyawa Mungkin kalian bingung dengan pengertian dari senyawa dan molekul. Apakah senyawa dan molekul memiliki definisi yang berbeda atau sama? Baiklah kita sekarang akan bahas terlebih dahulu tentang senyawa. Senyawa adalah zat yang…
- Pengertian , Struktur, Sistem Kerja dan Faktor yang… Pengertian , Struktur, Sistem Kerja dan Faktor yang Memengaruhi Kerja Enzim Pada Sistem Metabolisme Metabolisme adalah semua reaksi kimia yang terjadi pada sel hidup, Metabolisme meliputi Katabolisme dan Anabolisme. Katabolisme adalah…
- Makromolekul : Protein Kali ini kami akan membahas materi kimia tentang asam amino pada makromolekul. Protein Merupakan polimer alam yang tersusun dari asam-asam amino melalui ikatan peptida, sehingga protein juga disebut sebagai polipeptida.…
- Pengertian Energi, Satuan, Macam Bentuk dan… Pengertian Energi, Satuan, Macam Bentuk dan Pemanfaatan Energi – Energi adalah sebuah kemampuan untuk melakukan sebuah tindakan / pekerjaan (usaha). Kata “Energi” berasal dari bahasa yunani yaitu “ergon” yang berarti kerja.…
- Hidrolisis Garam – Pengertian, Ciri-Ciri Dan Sifat… Hidrolisis berasal dari kata hidro artinya air dan lisis artinya penguraian. Jadi, hidrolisis adalah reaksi penguraian dalam air. Hidrolisis garam adalah reaksi penguraian garam dalam air membentuk ion positif dan…
- Sistem Koloid – 8 Sifat Koloid Dan Penjelasan Terlengkap Koloid merupakan campuran yang berada di antara campuran homogen dan heterogen. Oleh karena itu, koloid mempunyai sifat-sifat khusus yang tidak dimiliki oleh campuran homogen dan campuran heterogen. Penjelasan beberapa sifat…
- Laju Reaksi Apa Itu Laju Reaksi? Jadi laju reaksi itu adalah ya, laju dari sebuah reaksi. Bagaimana pengurangan suatu konsentrasi pereaksi atau penambahan konsentrasi. Satuannya adalah mol dm-3 atau M s-1 Pengurangan…
- Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi… Pengertian Asam Basa, Sifat, Teori dan Contoh Reaksi Asam Basa Terlengkap – Tentu saja kita sering mendengar istilah asam basa dalam kimia. Kata asam berasal dari bahasa Latin acidu” yang berarti…
- Reaksi Redoks Ada yang sudah mengenal atau pernah mendengar mengenai Reaksi Redoks? Oke, mari simak penjelasan secara lengkapnya dibawah ini ya. Pengertian Reaksi Redoks Redoks merupakan sebuah istilah yang dapat menjelaskan adanya suatu…
- Pengertian dan Contoh Perubahan fisika Zat berdasarkan wujudnya dibedakan menjadi tiga jenis yaitu zat padat, zat cair dan zat gas. Zat bisa mengalami perubahan baik itu wujud, warna dan lain sebagainya. Perubahan zat ada dua yaitu perubahan fisika dan perubahan…
- Pengertian Zat atau Materi Apakah benda-benda memerlukan tempat? Misal air yang berada di dalam gelas kita tuangkan ke dalam kaleng. Apakah air menempati kaleng? Ternyata air memerlukan tempat atau wadah. Selanjutnya jika air dalam…
