Pengertian Sel Elektrolisis, Kegunaan atau manfaat dan Contoh Reaksi Sel Elektrolisis Terlengkap – Pada tahun 1989, terdapat dua ilmuwan mengumumkan bahwa mereka sudah mencapai “fusi dingin”, yaitu suatu proses fusi bersama unsur yang pada dasarnya terjadi pada suhu kamar untuk mencapai produksi energi.
Hipotesisnya yaitu bahwa fusi akan menghasilkan lebih banyak energi daripada yang dibutuhkan untuk menyebabkan proses terjadi. Proses mereka melibatkan elektrolisis air berat (molekul air yang mengandung beberapa deuterium bukan hidrogen normal) pada elektroda paladium. Percobaan tidak bisa direproduksi. Tettapi, dalam tahun-tahun terakhir, baik peneliti industri ataupun pemerintah melihat beberapa studi proses yang lain mengenai topik ini juga. Bagaimanapun, Fusi dingin mungkin tidak begitu “dingin”.
Sel elektrolisis
Sebuah sel volta menggunakan reaksi redoks spontan untuk menghasilkan suatu arus listrik. Hal tersebut juga memungkinkan untuk melakukan hal yang sebaliknya. Ketika sumber eksternal arus langsung diterapkan pada sel elektrokimia, reaksi yang biasanya tidak spontan bisa dibuat untuk berlangsung.
Elektrolisis yaitu proses di mana energi listrik dipakai untuk menyebabkan reaksi kimia tidak spontan akan terjadi. Elektrolisis bertanggung jawab atas munculnya banyak benda dalam kehidupan sehari-hari seperti perhiasan berlapis emas / berlapis perak dan bumper mobil berlapis krom.
Sebuah sel elektrolisis yaitu alat yang dipakai untuk melakukan reaksi elektrolisis. Dalam sel elektrolit, arus listrik diterapkan untuk menyediakan suatu sumber elektron untuk mendorong reaksi ke arah tidak spontan. Dalam sel volta, reaksi berjalan dalam arah yang melepaskan elektron secara spontan. Dalam sel elektrolit, masukan elektron dari sumber eksternal memaksa reaksi untuk pergi ke arah yang berlawanan.
Arah spontan untuk reaksi antara Zn dan Cu yaitu untuk logam Zn akan teroksidasi menjadi ion Zn2 +, sedangkan ion Cu2 + direduksi menjadi logam Cu. Hal tersebut membuat elektroda seng ialah anoda dan elektroda tembaga ialah katoda. Ketika setengah sel yang sama yang terhubung ke baterai melalui kawat eksternal, reaksi dipaksa untuk berjalan dalam arah yang berlawanan. Elektroda seng sekarang katoda dan elektroda tembaga anoda.
Potensi sel standar yaitu negatif, menunjukkan reaksi tidak spontan. Baterai harus mampu memberikan minimal yaitu 1.10 V arus searah agar reaksi akan terjadi. Perbedaan lain antara sel volta dengan sel elektrolitik yaitu tanda-tanda dari elektroda. Dalam sel volta, anoda ialah negatif dan katoda positif. Dalam sel elektrolit, anoda positif karena terhubung ke terminal positif baterai. Katoda karena itu negatif. Elektron masih mengalir melalui sel membentuk anoda ke katoda.
Kegunaan sel elektrolisis
Penyepuhan logam (electroplating)
Tujuan penyepuhan logam yaitu melapisi logam dengan logam lain agar tidak mudah berkarat. Misalnya pada penyepuhan perak yang biasa dilakukan pada peralatan rumah tangga seperti garpu, sendok, dan pisau.Logam yang akan disepuh dijadikan katode, logam penyepuh sebagai anode. Sebagai larutan elektrolit dipakai larutan yang mengandung logam penyepuh. Contoh : penyepuhan pada sendok besi oleh logam perak (Ag). Sendok besi dipasang sebagai katode dan logam perak berperan sebagai anode.Larutan elektrolitnya ialah larutan AgNO3.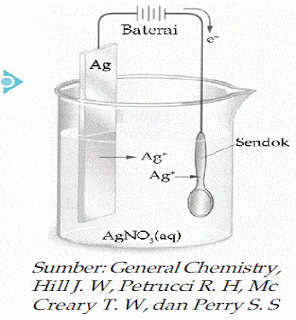
Anode : Ag à Ag+ + e
Ion Ag+ pada larutan akan menuju ke katode (kutub negative) dan tereduksi
Katode : Ag+ + e à Ag
Logam Ag yang terbentuk akan menempel pada sendok besi.
Produksi natrium
Sel elektrolisis pada produksi Natrium didapatkan dengan cara elektrolisis lelehan NaCl yang dikenal dengan Proses Down. Reaksi yang terjadi seperti:
Katode : 2 Na+(l) + 2 e– à 2 Na(l)
Anode : 2 Cl–(l) à Cl2(g) + 2 e–
2 Na+(aq)+2Cl–(aq) à 2 Na(l) + Cl2(g)
Produksi alumunium
Sel elektrolisis pada produksi Aluminium didapatkan dengan cara elektrolisis bijih aluminium. Reaksi yang terjadi seperti:
Katode : Al3+(aq) + 3 e– àAl(l)
Anode : 2 O2–(aq) à O2(g) + 4 e–
4Al3+(aq)+ 6O2–(aq) à 4 Al(l) + 3O2(g)

Demikian artikel tentang”Pengertian Sel Elektrolisis, Kegunaan dan Contoh Reaksi Sel Elektrolisis Terlengkap“, semoga bermanfaat dan jangan lupa ikuti postingan kami berikutnya.
Artikel Paling Populer :
- Glukosa Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Glukosa? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Glukosa Glukosa sering disebut juga dengan dekstrosa , d-glukosa ataupun gula buah. Glukosa…
- Pengertian, Susunan, Bagian, Lapisan, Spektrum dan… Pengertian Matahari , Susunan, Struktur Bagian, Lapisan, Spektrum dan Manfaat Matahari Bagi Kehidupan Terlengkap – Matahari adalah bintang yang mempunyai massa yang sangat besar. Karena gravitasinya, matahari menjadi pusat tata surya. Meskipun bukan…
- Unsur Nitrogen Definisi Nitrogen Nitrogen merupakan unsur kimia dalam tabel periodik yang mempunyai lambang N dan nomor atom 7. Unsur ini biasanya ditemukan dalam bentuk gas tanpa warna dan bau. Merupakan gas…
- Jenis-Jenis Energi Ada yang sudah mengenal atau pernah mendengar mengenai istilah Energi? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Energi Energi berasal dari bahasa Yunani yakni “ergon” yang artinya kerja. Dalam melakukan…
- Rekayasa Genetika Ada yang sudah mengenal atau pernah mendengar mengenai istilah Rekayasa Genetika? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Rekayasa Genetika Rekayasa genetika merupakan salah satu bioteknologi yang bisa meliputi manipulasi…
- Ikatan Kovalen ahukah anda apa yang dimaksud dengan ikatan kovalen ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada kesempatan kali ini akan membahas tentang pengertian ikatan kovalen, jenis-jenis…
- Pengertian Sistem Koloid berdasarkan Sifat dan Jenis Koloid adalah suatu campuran zat heterogen (dua fase) antara dua zat atau lebih di mana partikel-partikel zat yang berukuran koloid (fase terdispersi/yang dipecah) tersebar secara merata di dalam zat lain…
- Bintang Adalah Ada yang sudah mengenal atau pernah mendengar mengenai istilah Bintang? Simak penjelasan terlengkapnnya di bawah ini. Pengertian Bintang Bintang merupakan sebuah bola plasma besar yang memancarkan cahaya ke seluruh alam…
- Pengertian, Rumus dan Contoh Soal Perpindahan Kalor… Pengertian, Rumus dan Contoh Soal Perpindahan Kalor Secara Radiasi (Pancaran) Beserta Pemahaman Terlengkap – Jarak dari bumi ke matahari mencapai 149.600.000 km dan antara bumi dan matahari terdapat ruang hampa udara,…
- Reaksi Kesetimbangan Kimia Dalam Industri Dan… Berdasarkan azas Le Chatelier pada artikel sebelumnya, diketahui bahwa sistem yang berada dalam kesetimbangan akan selalu berusaha untuk mempertahankan kesetimbangannya. Dengan demikian, apabila terjadi aksi maka sistem akan mengalami pergeseran agar kesetimbangan tercapai…
- Penjelasan Ruang Lingkup Ilmu Kimia Terlengkap Ilmu yang mempelajari alam semesta disebut ilmu pengetahuan alam (,natural science = IPA). Ilmu kimia merupakan salah satu di antara ilmu-ilmu IPA. Ilmu pengetahuan alam sudah diajarkan sejak di Sekolah…
- Materi Atom Di dalam alam jagad raya ini terdapat beberapa partikel penyusun dari suatu unsur yang tidak bisa kita lihat dan kita rasakan kehadirannnya namun memang ada. Di dalam menyusun suatu unsur…
- 10 Jenis Pemanis Alami dan Kelebihannya untuk Tubuh Pemanis alami merupakan bahan pemberi rasa manis yang diperoleh dari bahan-bahan nabati maupun hewani. Contoh pemanis alami gula tebu, gula merah, madu, dan kulit kayu manis. Gula tebu mengandung zat…
- Korosi Adalah Ada yang sudah mengenal atau pernah mendengar mengenai Korosi? Pengertian Korosi Korosi merupakan salah satu hal yang terjadi akibat kerusakan atau degradasi logam akibat adanya sebuah reaksi redoks antara logam dengan…
- Pengertian Teori Tumbukan dan Faktor-Faktor yang… Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna.…
- SEL ELEKTROKIMIA SEL VOLTA (GALVANI) ELEKTROLISIS Energi kimia menjadi energi listrik Energi listrik diubah menjadi energi kimia Reaksi redoks spontan Reaksi redoks tidak spontan Katoda (+) dan anoda (-) Katoda (-) dan…
- Unsur Oksigen Hai sobat hitung, bagaimana kabarnya? Semoga tetap sehat dan semangat ya… Nah, kali ini kami akan menjelaskan sedikit tentang materi kimia, yaitu mengenai unsur oksigen dan nitrogen. Harus kalian ketahui…
- Laju Reaksi Ada yang sudah mengenal atau pernah mendengar mengenai Laju Reaksi? Oke, mari simak penjelasan secara lengkapnya dibawah ini ya. Pengertian Laju Reaksi Laju Reaksi ialah sebuah laju penurunan ( reaktan atau…
- Jenis-Jenis Logam Didalam kehiduapan sehari-hari kita sering kali kita melihat unsur logam yang ada di benda yang sering kita lihat, salah satu contohnya yaitu barang elektronik yang mengandung unsur logam didalamnya. Pada…
- Pengertian Teori Tumbukan dan Faktor-Faktor yang… Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna.…

