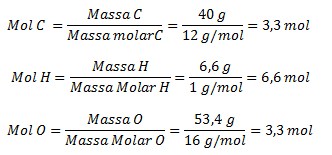Pengertian, Cara Menentukan, Contoh Soal Rumus Empiris dan Rumus Molekul Senyawa Lengkap – Rumus kimia merupakan salah satu ciri khas dari senyawa kimia. Rumus kimia terbagi menjadi 2 (dua) yaitu rumus empiris dan rumus molekul. Perbedaan rumus empiris dan rumus molekul terdapat pada jumlah atomnya, sedangkan atom unsur penyusun senyawanya sama.
Pengertian rumus molekul senyawa adalah rumus yang menyatakan jumlah dan jenis atom-atom dari unsur yang menyusun dalam 1 (satu) molekul senyawa, sedangkan pengertian rumus empiris adalah rumus yang menyatakan suatu perbandingan terkecil dari atom-atom yang menyusun suatu Senyawa. Rumus empiris tersebut menyatakan perbandingan jenis dan jumlah paling sederhana dari suatu senyawa. Rumus empiris diperoleh berdasarkan percobaan. Sebagai contoh, rumus molekul benzena adalah C6H6 maka rumus empirisnya adalah CH. Rumus molekul hidrogen peroksida adalah H2O2 maka rumus empirisnya adalah HO.
Rumus empiris bisa digunakan untuk menunjukkan rumus molekul jika tidak ada informasi mengenai massa molekul relatif dari suatu senyawa. Misalnya, NO2 bisa dikatakan sebagai rumus molekul jika tidak ada informasi massa molekul relatifnya. Namun jika massa molekul relatifnya diketahui, misalnya 92, maka NO2 merupakan rumus empiris karena rumus molekul senyawa tersebut adalah N2O4.
Cara Menentukan Rumus Empiris dan Rumus Molekul Senyawa
Cara menentukan rumus empiris yang perlu dilakukan yaitu mencari massa atau persentase massa dalam senyawa. Kemudian bagi dengan massa atom relatif (Ar) masing-masing unsur, artinya dalam menentukan rumus empiris perlu dicari perbandingan mol dari unsur-unsur dalam senyawa tersebut. Rumus empiris dan rumus molekul dapat dijabarkan sebagai berikut:
(Rumus Empiris)n = Rumus Molekul
Nilai n berkaitan dengan massa molekul relatif (Mr) suatu rumus kimia. Apabila Mr dari rumus empiris dikalikan dengan n, maka menghasilkan Mr rumus molekul. Prinsip tersebut digunakan sebagai dasar dalam mencari rumus molekul senyawa.
Contoh Soal Rumus Empiris dan Rumus Molekul Senyawa
Berikut beberapa contoh soal rumus empiris dan rumus molekul suatu senyawa:
1. Suatu Senyawa Organik tersusun dari 40 persen karbon, 6.6 persen Hidrogen dan sisanya Oksigen (Ar C=12, H=1, O=16). Jika Mr sebesar 90, maka tentukan Rumus Empiris dan Rumus Molekul Senyawa Organik tersebut?
Cara Penyelesaian
Diketahui:
Massa Senyawa sebesar 100 gram
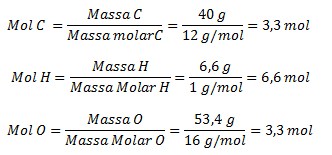
Mr = 90
A. Ditanya: Rumus Empiris?
Jawab:
Mol C : Mol H : Mol O = 3,3 : 6,6 : 3,3
Karena atom-atom dalam molekul merupakan kelipatan bilangan bulat maka perbandingan atom tersebut harus bilangan bulat dan harus lebih sederhana, sehingga harus membagi ketiga bilangan tersebut dengan kelipatan bilangan yang paling kecil yaitu 3,3. Maka, perbandingannya menjadi:
1 : 2 : 1
Perbandingan ini menyatakan perbandingan atom-atom paling sederhana dalam molekul. Dengan demikian, rumus empiris senyawa adalah CH2O.
B. Ditanya: Rumus Molekul?
(Rumus Empiris)n = Mr
(CH2O)n = 90
( 1 .Ar C + 2. Ar H + 1. Ar O)n = 90
(1. 12 + 2. 1 + 1. 16)n = 90
30n = 90
n = 3
Sehingga Rumus Molekul Senyawanya adalah C3H6O3.
2. Jika 17 gram suatu Oksida Logam dengan Rumus Empiris M2O3 memiliki kandungan 8 gram Oksigen dengan Ar O sebesar 16. Maka berapakah Ar Logam M tersebut?
Cara Penyelesaian
Diketahui:
Massa O = 8 gram
Massa M = 17 – 8 = 9 gram
Mol M : Mol O = 9/Ar M : 8/16 = 2 : 3
Sehingga Ar M adalah 27.
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian, Cara Menentukan, Contoh Soal Rumus Empiris dan Rumus Molekul Senyawa Lengkap .Semoga bermanfaat dan sampai jumpa pada postingan selanjutnya.
Artikel Paling Populer :
- Materi Lengkap Trigonometri Dengan Fungsi , Rumus… Materi Lengkap Trigonometri Dengan Fungsi , Rumus Dan Pembahasan Contoh Soal Dalam merancang kerangka sebuah jembatan perhitungan yang dilakukan tidaklah mudah. Beban, tegangan, serta gaya yang bekerja pada jembatan menjadi…
- Pengertian, Rumus, Contoh Soal Perbandingan Senilai… Pengertian, Rumus, Contoh Soal Perbandingan Senilai dan Berbalik Nilai dan Penyelesaiannya Lengkap – Dalam matematika terdapat materi pembelajaran tentang perbandingan. Materi perbandingan termasuk ke dalam golongan aritmatika. Perbandingan adalah usaha membandingkan…
- Pengertian, Sifat, Rumus dan Contoh Soal Tekanan… Pengertian, Sifat, Rumus dan Contoh Soal Tekanan Hidrostatis Beserta Pembahasan Terlengkap – Tekanan hidrostatis adalah tekanan yang diakibatkan oleh gaya yang ada pada zat cair terhadap suatu luas bidang tekan…
- Pengertian Senyawa Kimia, Ciri, Sifat, Jenis dan… Pengertian Senyawa Kimia, Ciri, Sifat, Jenis dan Tata Nama Senyawa Kimia Beserta Contohnya Lengkap – Senyawa kimia adalah zat kimia murni yang terdiri dari dua atau beberapa unsur yang bisa…
- Pengertian, Rumus dan Contoh Soal Mol, Molalitas,… Pengertian, Rumus dan Contoh Soal Menghitung Mol, Molalitas, Molaritas, Normalitas, Part Per Million (ppm), Persen Massa dan Persen Volume Larutan Lengkap – Dalam kimia, ada beberapa satuan yang sering digunakan untuk…
- Pengertian Gaya Berat, Rumus dan Contoh Soal Gaya… Pengertian Gaya Berat, Rumus dan Contoh Soal Gaya Berat Beserta Cara Penyelesaiannya Terlengkap – Dalam kehidupan sehari-hari, kita sering menggunakan gaya berat salah satu contohnya adalah saat kita menimbang barang.…
- Pengertian Kromatografi, Jenis Kromatografi dan… Pengertian Kromatografi, Jenis Kromatografi dan Penjelasan Lengkap – Kromatografi adalah teknik pemisahan molekul berdasarkan perbedaan pola pergerakan antara fase gerak dan fase diam untuk memisahkan komponen berupa molekul yang ada…
- Aturan Penulisan Rumus Kimia dan Nama Senyawa Sederhana Suatu senyawa sederhana dapat disusun oleh unsur logam dan unsur nonlogam atau unsur nonlogam dengan nonlogam. Aturan penamaan senyawa dipengaruhi oleh jenis unsur yang membentuknya. Oleh karena itu, aturan penamaan senyawa terbagi…
- Definisi dan Contoh Senyawa Terner Pada postingan kali ini akan membahas mengenai senyawa terner. Setelah artikel kami cari di mesin pencarian google tentang senyawa terner, malah kami kebingungan. Ada beberapa blog atau website yang menjelaskan bahwa “senyawa…
- Pengertian, Rumus dan Contoh Soal Molaritas,… Pengertian, Rumus dan Contoh Soal Molaritas, Pembuatan Larutan dan Pengenceran Lengkap – Kali ini kita aka membahas tentang pengertian dan rumus molaritas, pembuatan larutan dan pengenceran beserta dengan contoh soal dan…
- Cara Menentukan dan Menghitung Rumus Luas dan… Mengetahui Rumus hitung Luas dan Keliling Pada Trapesium Lengkap dengan Contoh Soal dan Pembahasannya Trapesium merupakan bangun datar dua dmensi yang dibentuk oleh empat buah rusuk yang dua diantara rusuknya…
- Pengertian, Rumus dan Bunyi Kirchhof 1 dan 2 Lengkap Pengertian, Rumus dan Bunyi Kirchhof 1 dan 2 Lengkap Dalam Ilmu Fisika Hukum kirchhoff merupakan salah satu hukum dalam ilmu elektronika yang berfungsi untuk menganalisis arus dan tegangan dalam sebuah…
- Ikatan Ion : Pengertian, Ciri, Dan Syarat… Ikatan Ion : Pengertian, Ciri, Dan Syarat Terjadinya, Beserta Contohnya Lengkap – Tahukah anda apa yang dimaksud dengan ikatan ion ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada…
- Ikatan Kovalen ahukah anda apa yang dimaksud dengan ikatan kovalen ??? Jika anda belum mengetahuinya anda tepat sekali mengunjungi gurupendidikan.com. Karena pada kesempatan kali ini akan membahas tentang pengertian ikatan kovalen, jenis-jenis…
- Pengertian, Rumus dan Contoh Soal Listrik Dinamis… Pengertian, Rumus dan Contoh Soal Listrik Dinamis Beserta Cara Penyelesaian Lengkap – Listrik dinamis (electronidinamic) berasal dari perpaduan kata listrik dan dinamis. Listris adalah listrik, sedangkan dinamis yaitu berubah-ubah atau bergerak.…
- Pengertian, Rumus & Contoh Soal Barisan Dan Deret… Pengertian, Rumus & Contoh Soal Barisan Dan Deret Geometri Beserta Penjelasan Lengkap – Terdapat dua jenis Barisan dan Deret di dalam matematika yaitu Barisan dan Deret Aritmatika & Barisan dan…
- Berbagai Bentuk Molekul, Pengertian Teori Domain… Setiap molekul yang tersusun dari atom unsur tertentu dengan jumlah yang tertentu pula akan mempunyai bentuk molekul tertentu. Bentuk molekul merupakan bentuk geometris yang terjadi jika inti atom unsur yang…
- Materi, Rumus, dan Contoh Kalimat Past Continuous Tense Materi, Rumus, dan Contoh Kalimat Past Continuous Tense - Di kesempatan kali ini kami akan membahas tentang Past Continuous Tense. Sesuai dengan judulnya, Past Continuous Tense adalah sebuah tense yang menunjukkan…
- Pengertian, Sifat, Jenis, Rumus dan Contoh Soal… Pengertian, Sifat, Jenis, Rumus dan Contoh Soal Trapesium Beserta Jawaban Lengkap – Trapesium adalah bangun datar dua dimensi tang dibentuk oleh 4 rusuk diantaranta saliung sejajar namun tidak sama panjang.…
- Penjelasan Lengkap Gaya Antarmolekul Menurut Para Ahli Kepolaran suatu senyawa dapat dipengaruhi oleh adanya perbedaan keelektronegatifan antar atom-atom yang berkaitan dengan bentuk molekul. Senyawa dikatakan bersifat polar apabila selisih keelektronegatifan antaratom penyusunnya semakin besar. Dan selain itu…